doi: 10.56294/sctconf2024.1008
REVISIÓN
Clinical and epidemiological implications of immune mechanisms in periodontitis
Implicaciones clínicas y epidemiológicas de los mecanismos inmunitarios en la periodontitis
Adriana Nicole Tobar Peñaherrera1 ![]() *, Myriam Ernestina Moya
Salazar1
*, Myriam Ernestina Moya
Salazar1 ![]() *, Cristian Vicente
Morocho Segarra1
*, Cristian Vicente
Morocho Segarra1 ![]() *, Luz Amelia Granda
Macías1
*, Luz Amelia Granda
Macías1 ![]() *
*
1Universidad Autónoma Regional de los Andes. Ambato, Ecuador.
Citar como: Tobar Peñaherrera AN, Moya Salazar ME, Morocho Segarra CV, Granda Macías LA. Clinical and epidemiological implications of immune mechanisms in periodontitis. Salud, Ciencia y Tecnología - Serie de Conferencias. 2024; 3:.1008. https://doi.org/10.56294/sctconf2024.1008
Enviado: 17-02-2024 Revisado: 21-05-2024 Aceptado: 03-09-2024 Publicado: 04-09-2024
Editor: Dr.
William Castillo-González ![]()
Autor para la correspondencia: Adriana Nicole Tobar Peñaherrera *
ABSTRACT
Periodontitis, considered a chronic inflammatory disease rather than a conventional bacterial infection, is characterized by a dysregulated immune response to the accumulation of bacterial biofilm in periodontal tissue. This inflammatory imbalance contributes to the loss of periodontal support and is influenced by factors such as unhealthy habits and systemic conditions. In Ecuador, the high prevalence of periodontal diseases reflects a significant problem, exacerbated by economic barriers, lack of access to adequate dental care and lack of knowledge about oral hygiene. The immune response to periodontitis involves both innate and adaptive immunity. Chronic inflammation, mediated by proinflammatory cytokines such as TNF-α and IL-1β, and the activity of matrix metalloproteinases (MMPs) are key determinants in the destruction of periodontal tissue. The interplay between microbial dysbiosis and inflammation reflects the need for therapeutic approaches that address both the control of bacterial biofilm and the modulation of the immune response. This study highlighted the complexity of periodontitis, underscoring the importance of strategies that integrate the understanding of chronic inflammation and the development of targeted therapies. The results indicated that personalization of treatment, based on individual profiles and specific biomarkers, influences the clinical outcomes of periodontal disease management. It is advisable to explore new technologies to effectively address this oral health challenge.
Keywords: Periodontal Tissue; Therapeutic Approaches; Bibliography.
RESUMEN
La periodontitis, considerada una enfermedad inflamatoria crónica en lugar de una infección bacteriana convencional, se caracteriza por una respuesta inmunitaria desregulada frente a la acumulación de biofilm bacteriano en el tejido periodontal. Este desbalance inflamatorio contribuye a la pérdida de soporte periodontal y está influenciado por factores como hábitos nocivos y condiciones sistémicas. En Ecuador, la alta prevalencia de enfermedades periodontales refleja una problemática significativa, exacerbada por barreras económicas, falta de acceso a atención dental adecuada y desconocimiento sobre higiene bucal. La respuesta inmune frente a la periodontitis involucra tanto la inmunidad innata como la adaptativa. La inflamación crónica, mediada por citocinas proinflamatorias como TNF-α e IL-1β, y la actividad de las metaloproteinasas de matriz (MMPs) son determinantes clave en la destrucción del tejido periodontal. La interacción entre disbiosis microbiana e inflamación refleja la necesidad de enfoques terapéuticos que aborden tanto el control del biofilm bacteriano como la modulación de la respuesta inmune. Este estudio destacó la complejidad de la periodontitis, subrayando la importancia de estrategias que integren la comprensión de la inflamación crónica y el desarrollo de terapias dirigidas. Los resultados indicaron que la personalización del tratamiento, basado en perfiles individuales y biomarcadores específicos, influye en los resultados clínicos del manejo de la enfermedad periodontal. Se aconseja explorar nuevas tecnologías para abordar eficazmente este desafío en salud bucal.
Palabras clave: Tejido Periodontal; Enfoques Terapéuticos; Bibliografía.
INTRODUCCIÓN
En la actualidad, la mayor parte de la evidencia acumulada indica que la periodontitis no es una enfermedad infecciosa convencional, sino una enfermedad inflamatoria, desencadenada por la respuesta inmunitaria del huésped frente a una reacción de microorganismos asociados al biofilm periodontal.(1,2) La placa bacteriana o biofilm es el agente etiológico más importante de las enfermedades periodontales, en donde las bacterias son solamente un estímulo para el sistema inmune, en el cual se encargan de activar varios mecanismos de defensa, mismos que en un intento de detener la infección, llegan a cambiar el metabolismo de los tejidos periodontales dando como consecuencia la pérdida de soporte periodontal.
Esta alteración juntamente con otros factores como hábitos nocivos y condiciones sistémicas tiene un papel importante en el desarrollo de la enfermedad periodontal.(2) En Ecuador, las enfermedades periodontales reflejan una problemática que afecta a una amplia franja de la población. Estas enfermedades, que afectan las encías y los tejidos de soporte de los dientes, se han convertido en una de las principales causas de pérdida dental en el país. A pesar de los avances en la salud bucal y la educación preventiva, las enfermedades periodontales siguen siendo una preocupación relevante debido a su alta prevalencia y a los efectos adversos que tienen en la calidad de vida de los afectados.
La situación de las enfermedades periodontales en Ecuador se caracteriza por una combinación de factores socioculturales, económicos y de acceso a servicios de salud. La falta de acceso a atención dental adecuada, las barreras económicas y el desconocimiento sobre la importancia de la higiene bucal contribuyen a la alta incidencia de estas condiciones. Además, factores como la dieta, el tabaquismo y la falta de educación en salud bucal juegan un papel crucial en la exacerbación de las enfermedades periodontales.
Las estadísticas locales indican que una proporción significativa de la población ecuatoriana presenta síntomas de periodontitis y gingivitis, enfermedades que, si no se tratan adecuadamente, pueden llevar a complicaciones severas como la pérdida de dientes y problemas de salud sistémica.
El sistema inmunológico es un componente crucial para la defensa del organismo contra enfermedades, ya que un desequilibrio en este sistema puede desencadenar trastornos que afectan el estado general del cuerpo. Las bacterias desempeñan un papel fundamental en la etiología de la periodontitis, al inducir la formación de bolsas periodontales, la destrucción del tejido conectivo y la reabsorción del hueso alveolar mediante mecanismos tanto directos como indirectos. Por lo tanto, el objetivo del sistema inmunológico es proteger al organismo contra la invasión de diversos agentes patógenos.
La inmunidad innata funciona como primera línea de defensa, eliminando la mayoría de los patógenos antes de que se inicie el proceso inflamatorio. Este sistema está compuesto por tres elementos principales: las barreras epiteliales como la piel, las mucosas y las secreciones; las proteínas antibacterianas circulantes; y las células del tejido, como los neutrófilos, que son células fagocíticas encargadas de patrullar el organismo en busca de patógenos, fagocitando y destruyendo los organismos invasores, aunque también pueden dañar los tejidos sanos durante el proceso inflamatorio.
El sistema inmune innato ofrece una protección inmediata contra los patógenos invasores, pero carece de capacidad para generar memoria inmunológica. La inmunidad adaptativa, por otro lado, está constituida por células y moléculas específicas para antígenos. Este sistema depende principalmente de los linfocitos, que permiten una respuesta inmune más eficaz en encuentros repetidos con el mismo antígeno, gracias a su capacidad para recordar el primer contacto con dicho antígeno.
En contraste, el sistema inmune adaptativo realiza ataques específicos contra los patógenos invasores, lo cual puede tardar días o semanas para alcanzar su máxima eficacia. Este proceso requiere una reorganización génica somática que da lugar a la memoria inmunológica. La inmunidad adaptativa se desarrolla a través de dos vías: la vía aferente, que evalúa si un elemento debe considerarse propio o no propio, y la vía eferente, que activa mecanismos para destruir el antígeno si es reconocido como no propio.
Durante la fase de presentación del antígeno, el antígeno ingresado al organismo es procesado por enzimas y estructuras celulares, convirtiendo a la bacteria o virus en péptidos antigénicos. Estos péptidos son transportados desde el citoplasma celular hasta la membrana plasmática, donde se exhiben en la superficie celular junto con las moléculas del Complejo Principal de Histocompatibilidad (HLA). Este proceso permite que los linfocitos reconozcan el antígeno procesado junto con las moléculas HLA, facilitando la identificación de lo propio y lo no propio en el organismo.
Las células del sistema inmunológico, como los linfocitos T y B, son responsables de la respuesta inmune específica. Los linfocitos B están especializados en la producción de inmunoglobulinas y ejecutan la respuesta humoral mediante la generación de anticuerpos en respuesta a estímulos antigénicos. Por su parte, los linfocitos T desarrollan una respuesta mediada por células; el proceso primario involucra el reconocimiento del antígeno por parte de los linfocitos T y B a través de la presencia de receptores específicos para dicho antígeno en su membrana celular.
Las células NK (Natural Killer) se originan en la médula ósea y carecen de los receptores de células T reorganizados. Estas células poseen la capacidad de eliminar células objetivo de manera directa, sin necesidad de sensibilización previa, mediante el contacto directo y la liberación de citoquinas proinflamatorias, en particular interferón-gamma. Las células NK son cruciales no solo en la defensa contra patógenos, sino también en la iniciación de respuestas inmunes adaptativas y en la regulación de mecanismos autoinmunes.
Son capaces de distinguir entre células propias y extrañas mediante la presencia o ausencia de moléculas de clase I del complejo principal de histocompatibilidad. Las células sanas expresan estas moléculas de clase I en su superficie, pero esta expresión está significativamente reducida en células infectadas por virus y células malignas.
Los anticuerpos o inmunoglobulinas son glicoproteínas sintetizadas por los linfocitos B Y células plasmáticas que tienen la propiedad de unirse de forma específica al antígeno. Los anticuerpos son un importante mecanismo de protección del hospedador en muchas infecciones bacterianas.
También median la protección del huésped a través de una variedad de mecanismos que incluyen la inhibición de la unión microbiana, agregación, opsonización y activación del sistema del complemento, lo que resulta en la prevención de la colonización, lisis de los microorganismos o neutralización de productos tóxicos.(3) Los linfocitos T y B son células del sistema inmune con capacidad para reconocer el antígeno mediante sus receptores de membrana específicos.
La molécula de inmuglobulina presenta una forma de Y, se definen una serie distinta de Inmunoglobulinas como IgG, IgA,IgM,IgD e IgE.Los dos brazos de la Y por separado tienen capacidad de unirse al antígeno. Su función es unirse a un antígeno y producir la activación del complemento, atravesar la placenta, unirse a ciertas proteínas microbianas, la unión del anticuerpo al antígeno es suficiente a veces para neutralizar la patogenicidad de un microorganismo o de una toxina microbiana. Otras veces esta unión de antígeno-anticuerpo no es suficiente y se necesitan otros mecanismos adicionales como la activación del complemento, la fagocitosis y opsonización.(1)
El sistema de complemento constituye un conjunto de proteínas que participan en la destrucción tisular y en los procesos inflamatorios, es considerado como un sistema enzimático antimicrobiano encontrado en suero y exudados inflamatorios como el gingival fluido crevicular, el complemento constituye una componente fundamental de la inmunidad innata, por su capacidad de dirigir eventos durante respuestas inmunitarias e inflamatorias, que incluyen la regulación de otras inmunidades innatas o adaptativas.(1,4) Su desencadenamiento involucra la activación secuencial y la escisión proteolítica de una serie de proteínas séricas, que conducen al reclutamiento y activación de células inflamatorias, opsonización microbiana y fagocitosis, y lisis directa de patógenos. Además de los componentes del suero, el sistema de complemento integrado también incluye reguladores y receptores unidos a la membrana para interacciones con varios mediadores del sistema inmunitario.(5)
Su activación se puede producir a través de tres mecanismos distintos, la vía clásica, lectina o vía alternativa. Estas convergen en un paso central que implica la activación del tercer componente del complemento (C3) por convertasas C3 específicas de la vía. La activación de la vía clásica se inicia por complejos antígeno-anticuerpo, mientras que la vía de la lectina se desencadena a través de la interacción de un receptor de reconocimiento de patrones secretado la unión a manosa lectina con carbohidratos específicos grupos en la superficie de una variedad de microorganismos.(6) La vía alternativa se activa por bacterias polisacáridos, o IgA agregada, a través del factor P C3. C3b, y los factores B y D convierten C5 enC5a y C5b y la cascada continúa hasta completarse. Tanto la gingivitis como la periodontitis crónica han sido caracterizadas principalmente como activadores de la vía alternativa.(6)
También, los macrófagos, son células fagocíticas que pueden viajar fuera del sistema circulatorio por movimiento a través de las paredes de los vasos sanguíneos, actúan en todas las etapas de la respuesta inmune y como primera línea de defensa antes de la activación de los linfocitos T, después de fagocitar y procesar el antígeno, actúan como células presentadoras de antígeno, a su vez producen citoquinas importantes para la respuesta inmune.
Los neutrófilos, son células fagocíticas que actúan como vigilantes o guardianes que recorren el cuerpo en busca de patógenos, a su vez estos fagocitan y matan los organismos invasores y también dañan los tejidos sanos durante la etapa de inflamación. Son importantes en los mecanismos de defensa del huésped. Aparecen en todos los procesos inflamatorios, en especial los agudos, atraídos por quimiotaxis.(6)
Estas dos células fagocíticas tienen receptores de superficie que reconocen y unen las moléculas de superficie de las bacterias. Estos distinguen entre el huésped y la bacteria, después del reconocimiento de microorganismos y sustancias extrañas, las quimiocinas son secretadas para atraer a los fagocitos. Los mastocitos, son de gran importancia debido a la presencia de gránulos en su citoplasma que contienen histamina, heparina y bradiquinina que se liberan en los tejidos. La vasodilatación inducida por histamina por el aumenta flujo sanguíneo y reclutamiento de fagocitos.(7)
Las citocinas y quimiocinas, Bunte K, Beikler T.(6) en el 2019 mencionaron que la respuesta inmune a la infección está regulada por estas y a su vez define a las citoquinas como proteínas de bajo peso molecular involucrado en la iniciación y etapas posteriores de inflamación, en la que regulan la amplitud y la duración de la respuesta. Las citoquinas son producidas por células epiteliales y fibroblastos, y por fagocitos neutrófilos y macrófagos en la fase aguda y temprana en fases crónicas de la inflamación, y por células inmunitarias linfocitos en lesiones establecidas y avanzadas.(8)
Las quimiocinas juegan un papel muy importante en la migración de células fagocíticas al sitio de la infección, proporcionan mensajes que conducen a otros procesos biológicos, como la angiogénesis, la proliferación celular, apoptosis, metástasis tumoral y defensa del huésped.(3)
En el contexto de la enfermedad periodontal, las citocinas están involucradas en la inflamación y destrucción de tejidos alrededor de los dientes (figura 1).
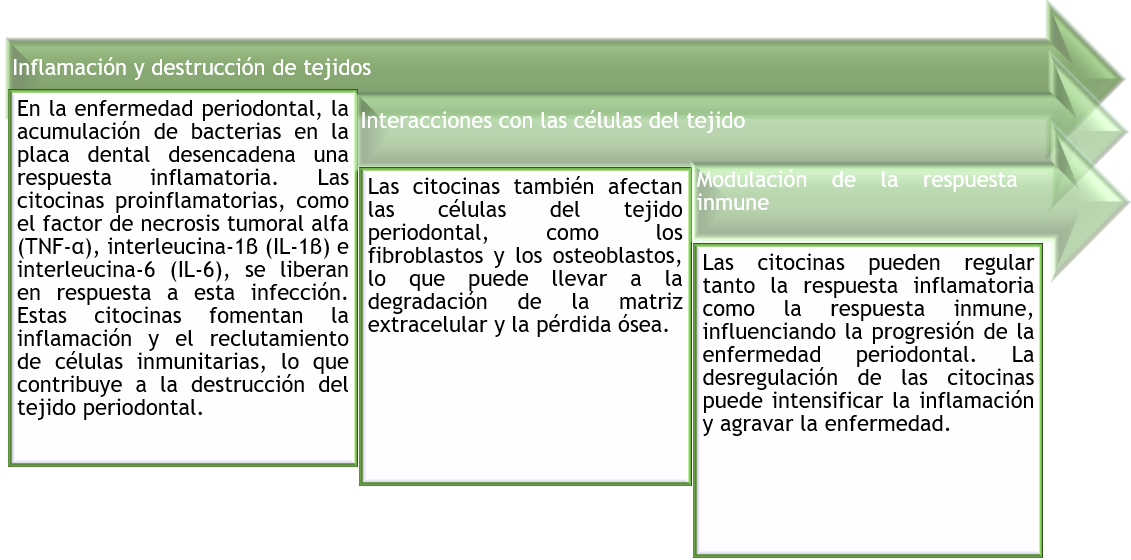
Figura 1. Relación de la inmunología con la periodoncia
En el 2019, Pan W, Wang Q, Chen Q.(8) determinaron que, si bien la iniciación de la gingivitis y la periodontitis son los microrganismos presentes como una estructura organizada constituyendo un biofilm, la patogénesis y la destrucción del tejido es impulsada por una respuesta inmune crónica e inflamatoria, cuya naturaleza y extensión son determinantes fundamentales de la susceptibilidad y la progresión de la enfermedad. Después del reconocimiento y la presentación de microorganismos a las células apropiadas las citocinas de la respuesta innata, incluido el factor de necrosis tumoral alfa, interleucina-1beta e interleucina-6, son las primeras aparecer en la patogénesis de la enfermedad periodontal.(9)
La Interleucina-1beta e interleucina-6 son citoquinas asociadas con migración de células inflamatorias migración y osteoclastos. El factor de necrosis tumoral alfa es una citocina multi-efecto que tiene muchas funciones, desde la migración celular hasta destrucción de tejido. Afecta la migración celular al inducir la regulación positiva de la adhesión de moléculas para la adhesión de los neutrófilos a la pared del vaso, lo que lleva a la extravasación. El factor de necrosis alfa también se correlaciona con la degradación de la matriz extracelular y la resorción ósea a través de acciones que promueven la secreción de metaloproteinasas de la matriz y RANKL.(1)
Para la respuesta inmune en la enfermedad periodontal, las bacterias son esenciales para su inicio, pero existen diferentes factores como el tabaquismo y genética que pueden ser determinantes para desarrollar la enfermedad periodontal. Las bacterias causan la destrucción tisular activando diversos componentes del sistema inmune del paciente, actuando no solo como protección sino también de defensa al mismo tiempo que serán en algún grado responsables de la destrucción en las diferentes etapas inflamatorias de la enfermedad.(2)
Los mecanismos de actuación de los factores de virulencia son directos por invasión de los tejidos produciendo sustancias nocivas que llevaran a la muerte celular e indirectos por la activación de células inflamatorias que sean capaces de producir y liberar una serie de mediadores que actúan sobre efectores, con una potente actividad proinflamatoria. Los neutrófilos actúan defendiendo y fagocitando. Si la defensa es adecuada sucederá una gingivitis y una enfermedad limitada, pero si es inadecuada habrá una penetración bacteriana que generará una periodontitis que pasará por diversas etapas y grados de severidad.(2,7)
Se llega con ello a la actuación del eje linfocito-monocito y a la liberación de los mediadores inflamatorios y citoquinas que destruirán el tejido, expresado clínicamente por la formación de la bolsa periodontal y la pérdida de hueso.(1) En cuanto a la destrucción de tejidos periodontales, el epitelio de unión proporciona una barrera muy eficaz contra los agentes patógenos periodontales y sus productos metabólicos.
Microrganismo periodonto patógenos como Porphyromonas gingivalis, pueden afectar el epitelio de unión, al permitir la diseminación subgingival de sus antígenos.(10) La consecuente respuesta inflamatoria conduce a la degradación del tejido conectivo subyacente, primero alrededor de los vasos sanguíneos y luego en zonas adyacentes, ocasionando la desintegración estructural y funcional de la encía.
Unos de los primeros cambios de la periodontitis son la migración del epitelio de unión a lo largo de la superficie radicular y su elongación, lo que conduce a la formación de un epitelio de unión largo y de una bolsa periodontal. Esta alteración estructural se ve afectada por cambios funcionales en la cual se encuentra la dirección de la migración de los neutrófilos y del flujo el exudado crevicular a través del epitelio cambia drásticamente, ya que la superficie libre del epitelio es desplazada desde el fondo del surco hasta la superficie de la raíz, la superficie libre aumenta en tamaño y, por lo tanto, está expuesta a más placa bacteriana.(10)
Las bacterias causan la destrucción tisular indirectamente, mediante la exacerbación de la respuesta inmunitaria del hospedador inmunitarias adquiridas que en la progresión de la enfermedad periodontal involucran a los linfocitos B, los linfocitos T y mediadores inflamatorios.(6) En cuanto a la destrucción ósea, diversas citocinas proinflamatorias y factores de crecimiento, especialmente la IL-1 y el factor de necrosis tumoral TNF, están asociados con la resorción del hueso.(11) En el tejido gingival con presencia de enfermedad periodontal, los linfocitos B y T son los principales productores del factor de diferenciación de los osteoclastos, el ligando del receptor activador del factor nuclear ÎB (RANKL), el cual induce la diferenciación y la activación de osteoclastos y dando lugar a una resorción ósea.
Xiaozhe Han y Cols(1,6) mencionaron diferentes estudios en las cuales se determinó la relación entre la resorción ósea y la presencia de Linfocitos T, debido a la presencia de osteoclastos existentes sobre la cresta de hueso alveolar de los animales que reciben linfocitos específicos de antígeno. Estos pueden ser suprimidos por la proteína de fusión osteoprotegerinas (OPG-Fc), un inhibidor de RANKL, lo que implica que la inducción de la resorción de hueso periodontal mediada por linfocitos depende de RANKL.
Las citocinas proinflamatorias como la IL-1 y el TNF son muy importantes en la pérdida de hueso periodontal, regulan la expresión de RANKL y osteoprotegerinas, los linfocitos T también expresan RANKL, que, uniéndose directamente al RANK en la membrana celular de los progenitores de osteoclastos, preosteoclastos y osteoclastos, estimula tanto la diferenciación celular como la activación de las células del linaje de los osteoclastos.(12)
No sólo se han hallado evidencias de resorción ósea mediada por linfocitos en la enfermedad periodontal, sino también en la artritis reumatoide. Esto ha atraído un interés creciente para emprender investigaciones con el objetivo de desarrollar abordajes terapéuticos que interfieran con los linfocitos T y B efectores del sistema inmunitario, los cuales producen RANKL y otros factores que activan e inducen la diferenciación de los osteoclastos según los hallazgos de los autores de este documento y en los de otros investigadores.(5)
Lipopolisacárido de diferentes patógenos estimulan la resorción ósea in vitro, la activación del receptor tipo Toll 2 y toll-like receptor 6 por lipopolisacridos causa expresión mejorada de RANKL a través de una proteína mieloide de respuesta primaria. Además, osteoclastos y sus precursores expresan receptores, especialmente receptores tipo 2, 4.(1,3)
El RANKL, es una pieza clave intermedia en la ruta que conecta las células inmunitarias con la pérdida patológica de hueso, bases biológicas de la actividad de RANKL. Es expresado por osteoblastos, células estromales, condrocitos y otras células mesenquimales. Las células T activadas y las células B también pueden expresar RANKL.(1) RANKL, ligando del RANK (receptor activador del factor nuclear κB [FN-κB]), es una citocina relacionada con TNF participa en la osteogénesis fisiológica, sino también en la pérdida patológica de hueso, su receptor de la superficie celular RANK y un receptor anzuelo soluble para RANKL, la osteoprotegerina (OPG), son tres piezas clave que regulan la diferenciación y la función de los osteoclastos.
Resulta muy importante señalar que los linfocitos, en especial los diferentes subtipos de linfocitos T, participan en la activación o la inhibición de la resorción ósea periodontal mediada por RANKL. Por ejemplo, los linfocitos Th1 estimulan la pérdida de hueso, mientras que los linfocitos T reguladores suprimen dicha pérdida mediada por los Th1.(9)
La producción de RANKL por las células inmunitarias en la enfermedad periodontal, los linfocitos t, también los B, expresan RANKL en el tejido gingival humano con enfermedad periodontal. En este artículo se menciona también que la proporción de ácido ribonucleico mensajero de RANKL es mayor en las células inflamatorias de pacientes con periodontitis avanzada, en comparación con los pacientes con una enfermedad moderada o con los individuos sanos, lo que sugiere una posible participación de RANKL en la destrucción ósea, mediada por osteoclastos, en la periodontitis.(1,6)
Por consiguiente, en la destrucción de la matriz extracelular, las colagenasas junto con otras metaloproteinasas de matriz, juega un papel importante en la destrucción del tejido periodontal. Las metaloproteinasas de matriz son una familia de enzimas estructuralmente relacionadas, pero genéticamente distintas que degradan la matriz extracelular y los componentes de la membrana basal. Están involucradas en procesos fisiológicos tales como el desarrollo de tejidos, remodelación y curación de heridas.(12)
Las metaloproteinasas de la matriz están regulados al aumento de la inflamación periodontal. La expresión y la liberación patológica de la matriz es producida neutrófilos, células epiteliales, fibroblastos, células endoteliales, monocitos macrófagos y células plasmáticas. En la enfermedad periodontal la secreción de metaloproteinasas de matriz específica es estimulado o regulado por diferentes citocinas.
Las principales citoquinas estimuladoras para la matriz las metaloproteinasas son factor de necrosis tumoral alfa, interleucina-1 e interleucina-6. Los linfocitos T y B presentes en las lesiones inflamatorias desempeñan un papel crucial en la estimulación de la resorción ósea periodontal a través de mecanismos dependientes e independientes de RANKL.(4,12)
De acuerdo con lo planteado, en el presente estudio se pretende evaluar la respuesta inmunológica en la patogénesis de la periodontitis en Ecuador, analizados los mecanismos de inflamación y la interacción entre el sistema inmunitario y los microorganismos del biofilm periodontal, con el fin de identificar factores determinantes para esta enfermedad.(11)
MÉTODO
Este artículo se fundamentó en una revisión bibliográfica exhaustiva para analizar la respuesta inmunológica en la periodontitis y su progresión. Se utilizó una metodología de revisión sistemática para compilar y evaluar estudios relevantes, con el objetivo de ofrecer una visión integral sobre el papel del sistema inmunológico en la enfermedad periodontal. La revisión se centró en investigaciones publicadas en revistas científicas y bases de datos académicas sobre periodontitis, respuesta inmunitaria, y mecanismos de destrucción ósea.
La búsqueda de estudios se realizó en bases de datos académicas como PubMed, Google Scholar, y Scopus. Se utilizaron términos de búsqueda específicos como “periodontitis”, “respuesta inmunitaria”, “RANKL”, “metaloproteinasas de matriz”, y “citocinas inflamatorias”. Los artículos identificados fueron revisados en función de su título y resumen para determinar su relevancia. Posteriormente, se realizó una lectura completa de los artículos seleccionados para evaluar su calidad y pertinencia.
Análisis y síntesis: Los datos extraídos fueron analizados para identificar patrones y tendencias comunes en los estudios revisados. Se realizó una síntesis de la información para destacar los mecanismos inmunológicos clave implicados en la periodontitis, incluyendo la función de RANKL, las citocinas proinflamatorias, y las metaloproteinasas de matriz. Esta síntesis permitió desarrollar una comprensión integral de cómo la respuesta inmunitaria contribuye a la progresión de la enfermedad periodontal y las posibles estrategias terapéuticas basadas en los hallazgos.
RESULTADOS Y DISCUSIÓN
Acorde a la investigación realizada se presenta en la tabla 1 el resumen del análisis.
|
Tabla 1. Resumen del estudio bibliográfico |
||
|
Autores |
Conclusión de la revisión bibliográfica |
Resultados |
|
Yang B, Pang X, Li Z et al. 2021 |
Aumenta la actividad de los leucocitos y de las moléculas inflamatorias, que pueden eliminar la inflamación, pero esta actividad excesiva puede causar un gran daño a los tejidos periodontales, incluido el hueso alveolar. El tratamiento de la periodontitis mediante la modulación del microambiente inmunitario es una estrategia prometedora. |
Se han logrado grandes avances en el estudio de los cambios en el microambiente inmunitario de la periodontitis a través de la investigación de varios leucocitos y citocinas que desempeñan funciones clave. |
|
Bui F, Almeida-da-Silva C, Huynh Bet al. 2019 |
Los microorganismos orales contribuirán al objetivo de usar la cavidad oral para diagnosticar y posiblemente tratar enfermedades sistémicas no orales. |
Recientes estudios epidemiológicos, clínicos y experimentales avalan la relación entre la bacteriemia o inflamación por enfermedad periodontal y la enfermedad sistémica. |
|
Lamont R, Koo H, Hajishengallis G. 2018 |
En la periodontitis, la inflamación y la disbiosis se desarrollan conjuntamente de manera recíprocamente reforzada, y su interacción se desarrolla para convertirse en el impulsor de la periodontitis en individuos susceptibles. |
Los avances en tecnologías y la mejora en la conservación de bases de datos y la bioinformática han mejorado la identificación de redes microbianas activas y sus productos. Brinda mejores oportunidades para desarrollar enfoques terapéuticos altamente precisos y eficaces. |
|
Kowalski J, Nowak M, Gorski Bet al. 2022 |
La periodontitis se considera un factor de riesgo establecido, existe la posibilidad de descubrir nuevas conexiones en un futuro próximo. Esas asociaciones están estrictamente relacionadas con la reacción inmunológica. |
La afinidad del paciente por desarrollar enfermedad periodontal como síntoma de un camino rápido hacia enfermedades crónicas, en oposición a la curva de envejecimiento suave. |
|
Sun X, Gao J, Meng X et al. 2021 |
La EP, es un problema que debe abordarse en varios tratamientos orales. La activación de los osteoclastos es el comienzo de la progresión de la gingivitis a la EP. |
La eliminación de la inflamación y la protección de los tejidos es una de las claves del tratamiento de la periodontitis. Detener la inflamación y promover la reparación de tejidos será el enfoque de la terapia farmacológica para la periodontitis. |
|
Huang N, Dong H, Luo Yet al. 2021 |
Las células Th17 y la periodontitis está lejos de ser suficiente. La patogenia de la periodontitis y el papel esencial de las células Th17 en ella. También algunos moduladores de las células Th17 podrían ser futuras dianas terapéuticas. |
El excelente desempeño de A20 en la restricción de las células Th17, puede ser un objetivo potencial para restringir la inflamación periodontal y la reabsorción ósea, pero todavía hay muchas preguntas abiertas sobre si hay más explicaciones para la interacción entre estos. |
|
Bunte K, Beikler T. 2019 |
La IL-17 juega un papel importante en los eventos inflamatorios que conducen a la Manifestación de periodontitis. La periodontitis a menudo se observa en pacientes diagnosticados con una enfermedad inflamatoria inmunomediada.
|
Los inhibidores de citoquinas en enfermedades mucocutáneas gingivales, periodontales y orales son escasos. Se necesita más investigación sobre los efectos de los productos biológicos en los tejidos gingivales, periodontales y orales para dilucidar aún más el papel de las células Th17 y el eje IL-23/IL-17 en la patogenia. |
|
Williams D, Greenwell-Wild T, Brenchley L et al. 2021 |
La mucosa oral sigue siendo un tejido de barrera poco estudiado. Este es un sitio de rica exposición a antígenos y comensales, y un tejido susceptible a una de las enfermedades inflamatorias humanas más prevalentes, la periodontitis. |
El complejo paisaje celular de los tejidos de la mucosa oral y poblaciones de células epiteliales y estromales con firmas inflamatorias que promueven las defensas antimicrobianas y el reclutamiento de neutrófilos. Vinculan la capacidad de respuesta exagerada de las células del estroma con una mayor infiltración de neutrófilos y leucocitos en la periodontitis. |
|
Pan W, Wang Q, Chen Q. 2019 |
Los estudios destinados a comprender la inmunidad periodontal del huésped y la red de citoquinas involucrada han reportado resultados sorprendentes. Estos hallazgos recuerdan que el entorno específico alrededor del tejido periodontal conduce al modo específico de homeostasis en individuos sanos y a la patogenia de la periodontitis. |
El papel crucial de las células Th17 y sus citocinas relacionadas en la inmunidad específica del tejido periodontal. Además, con el rápido desarrollo de la tecnología unicelular, muchos subconjuntos de inmunocitos y citoquinas recientemente identificadas cuyas funciones en el tejido periodontal no han sido determinadas. |
|
MacDonald K, Chanyi R, Macklaim J et al. 2021 |
S. salivarius K12 y M18 pudieron producir una pequeña molécula proteica capaz de inhibir la activación de IL-6 e IL-8 de fibroblastos gingivales humanos primarios por patógenos de enfermedades periodontales. Sin embargo, esta molécula no era una bacteriocina y no era capaz de inhibir el crecimiento de estos patógenos. |
La administración conjunta del efector y el patógeno no es necesaria y que S. salivarius se puede aplicar antes de la exposición al patógeno. Esta administración no altera la microbiota salival nativa ni estimula una respuesta inmune. S. salivarius justificaría más estudios utilizando una población predispuesta a la enfermedad periodontal. |
|
Tan J, Dai A, Pan L et al. 2021 |
El mecanismo de inflamación-envejecimiento en el desarrollo de la periodontitis aún se encuentra en sus etapas iniciales. La IL-17 y el IFN- γ podrían mejorar la osteoclastogénesis in vitro, mientras que su efecto proosteoclastogénico solo actuó en los BMM preparados con RANK. |
Tanto la IL-17 como el IFN- γ podrían aumentar la inflamación local en los tejidos gingivales. Aunque podría haber una interacción antagónica entre IL-17 e IFN- γ , IL-17 e IFN- γ podrían facilitar la pérdida de hueso alveolar y la diferenciación de osteoclastos. |
|
Ren L, Yang J, Wang Jet al. 2021 |
La periodontitis es una enfermedad inflamatoria crónica que se caracteriza por la destrucción de las estructuras de soporte de los dientes, como las encías, los ligamentos periodontales y el hueso alveolar. |
FOXO1 puede funcionar principalmente como un regulador homeostático que coordina las respuestas a las señales ambientales que alteran la homeostasis periodontal. Sin embargo, la evidencia directa del mecanismo de acción en los tejidos periodontales requiere más estudio. |
Los resultados de la revisión bibliográfica subrayan la importancia del microambiente inmunitario en la patogénesis de la periodontitis. La inflamación excesiva, mediada principalmente por leucocitos y citocinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α), interleucina-1β (IL-1β) e interleucina-6 (IL-6), resulta en daño significativo a los tejidos periodontales, incluyendo la pérdida de hueso alveolar. Esta observación es consistente con la idea de que, mientras las bacterias inician la respuesta inflamatoria, la destrucción tisular y ósea es el resultado de una inflamación desregulada y persistente.
En la enfermedad periodontal, la interacción entre disbiosis microbiana y respuestas inmunitarias inflamatorias es recíproca y se refuerza mutuamente, como lo sugieren Lamont et al. (2018).(5) La disbiosis no solo perpetúa la inflamación, sino que también es exacerbada por la respuesta inmune del huésped. Esta interacción dinámica refuerza la necesidad de desarrollar estrategias terapéuticas que no solo aborden la presencia del biofilm microbiano sino que también modulen la respuesta inflamatoria para prevenir la progresión de la enfermedad.
La función de las células T, particularmente las células T helper 17 (Th17), y los mecanismos asociados con RANKL (ligando del receptor activador del factor nuclear κB) son fundamentales en la progresión de la periodontitis. Los estudios han demostrado que la producción de RANKL por linfocitos T y B contribuye a la resorción ósea mediante la activación de osteoclastos. La identificación de mecanismos específicos, como la interacción entre RANKL y su receptor RANK, abre posibilidades para el desarrollo de terapias dirigidas que puedan intervenir en la ruta de la resorción ósea.
El papel de las metaloproteinasas de matriz (MMPs) también es significativo en la destrucción de tejidos periodontales. Las MMPs, reguladas por citocinas inflamatorias, contribuyen a la degradación de la matriz extracelular y, por ende, a la pérdida de tejido periodontal. Este hallazgo refuerza la necesidad de estrategias terapéuticas que no solo se centren en la modulación de la inflamación, sino también en la inhibición de la actividad de MMPs para preservar la integridad del tejido periodontal.
El impacto de factores adicionales, como el tabaquismo y predisposiciones genéticas, también es crucial en la susceptibilidad a la periodontitis. Estos factores pueden influir en la intensidad de la respuesta inmune y en la eficacia de las respuestas terapéuticas. Así, la identificación de biomarcadores específicos y la personalización del tratamiento basados en perfiles individuales podrían mejorar significativamente los resultados clínicos.
CONCLUSIONES
El presente estudio de revisión bibliográfica proporcionó una visión integral sobre la patogénesis de la periodontitis, destacando la compleja interacción entre el sistema inmunológico y los factores microbianos.
La periodontitis no debe considerarse únicamente como una enfermedad infecciosa, sino más bien como una respuesta inflamatoria crónica desencadenada por la interacción entre el biofilm bacteriano y la respuesta inmune del huésped. La respuesta inflamatoria exacerbada puede conducir a una significativa destrucción de los tejidos periodontales y óseos, principalmente a través de mecanismos mediadores como la liberación de citocinas proinflamatorias (IL-1, TNF) y la producción de RANKL, que promueve la resorción ósea.
Es evidente que la enfermedad periodontal es un fenómeno complejo que resulta de la interacción entre factores microbianos y la respuesta inmune del huésped. Las investigaciones futuras deberían enfocarse en entender mejor los mecanismos de la inflamación crónica y en desarrollar terapias que puedan modular eficazmente el entorno inmunológico para prevenir y tratar la periodontitis de manera más efectiva. La integración de nuevas tecnologías y enfoques biomoleculares promete ofrecer perspectivas innovadoras para abordar este desafío persistente en la salud bucal.
REFERENCIAS BIBLIOGRÁFICAS
1. Yang B, Pang X, Li Z, Chen Z, Wang Y. Immunomodulation in the treatment of periodontitis: Progress and perspectives. Front Immunol [Internet]. 2021;12:781378. Available from: https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2021.781378/full
2. Bui FQ, Almeida-da-Silva CLC, Huynh B, Trinh A, Liu J, Woodward J, et al. Association between periodontal pathogens and systemic disease. Biomed J [Internet]. 2019;42(1):27–35. Available from: https://www.sciencedirect.com/science/article/pii/S2319417018302634
3. Williams DW, Greenwell-Wild T, Brenchley L, Dutzan N, Overmiller A, Sawaya AP, et al. Human oral mucosa cell atlas reveals a stromal-neutrophil axis regulating tissue immunity. Cell [Internet]. 2021;184(15):4090–104. Available from: https://www.cell.com/cell/fulltext/S0092-8674(21)00630-9?elqTrackId=03e80357c9ab42a8a06c3295057dbe99
4. Huang N, Dong H, Luo Y, Shao B. Th17 cells in periodontitis and its regulation by A20. Front Immunol [Internet]. 2021;12:742925. Available from: https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2021.742925/full
5. Lamont RJ, Koo H, Hajishengallis G. The oral microbiota: dynamic communities and host interactions. Nat Rev Microbiol [Internet]. 2018;16(12):745–59. Available from: https://www.nature.com/articles/s41579-018-0089-x
6. Bunte K, Beikler T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases. Int J Mol Sci [Internet]. 2019;20(14):3394. Available from: https://www.mdpi.com/1422-0067/20/14/3394
7. Kowalski J, Nowak M, Górski B, Górska R. What Has Immunology Brought to Periodontal Disease in Recent Years? Arch Immunol Ther Exp (Warsz) [Internet]. 2022;70(1):26. Available from: https://link.springer.com/article/10.1007/s00005-022-00662-9
8. Pan W, Wang Q, Chen Q. The cytokine network involved in the host immune response to periodontitis. Int J Oral Sci [Internet]. 2019;11(3):30. Available from: The cytokine network involved in the host immune response to periodontitis. International Journal of Oral Science
9. Sun X, Gao J, Meng X, Lu X, Zhang L, Chen R. Polarized macrophages in periodontitis: characteristics, function, and molecular signaling. Front Immunol [Internet]. 2021;12:763334. Available from: https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2021.763334/full
10. MacDonald KW, Chanyi RM, Macklaim JM, Cadieux PA, Reid G, Burton JP. Streptococcus salivarius inhibits immune activation by periodontal disease pathogens. BMC Oral Health [Internet]. 2021;21(1):245. Available from: https://link.springer.com/article/10.1186/s12903-021-01606-z
11. Tan J, Dai A, Pan L, Zhang L, Wang Z, Ke T, et al. Inflamm‐aging‐related cytokines of IL‐17 and IFN‐γ accelerate osteoclastogenesis and periodontal destruction. J Immunol Res [Internet]. 2021;2021(1):9919024. Available from: https://onlinelibrary.wiley.com/doi/full/10.1155/2021/9919024
12. Ren L, Yang J, Wang J, Zhou X, Liu C. The roles of FOXO1 in periodontal homeostasis and disease. J Immunol Res [Internet]. 2021;2021(1):5557095. Available from: https://onlinelibrary.wiley.com/doi/full/10.1155/2021/5557095
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Curación de datos: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Análisis formal: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Investigación: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Metodología: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Administración del proyecto: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Recursos: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Software: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Supervisión: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Validación: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Visualización: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Redacción – borrador original: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.
Redacción – revisión y edición: Adriana Nicole Tobar Peñaherrera, Myriam Ernestina Moya Salazar, Cristian Vicente Morocho Segarra, Luz Amelia Granda Macías.