REVISIÓN
Affections in white shrimp cultures due to the white spot syndrome virus
Afectaciones en cultivos de camarón blanco por del virus del síndrome de la mancha blanca
Raúl González Salas1
![]() *, Darwin Rafael
Villamarín Barragán1
*, Darwin Rafael
Villamarín Barragán1 ![]() *, Marcelo
Alejandro Jiménez Villa1
*, Marcelo
Alejandro Jiménez Villa1
![]() *, Matías Gabriel Jaramillo López1
*, Matías Gabriel Jaramillo López1
![]() *
*
1Universidad Regional Autónoma de Los Andes. Ambato, Ecuador.
Citar como: González Salas R, Villamarín Barragán DR, Jiménez Villa MA, Jaramillo López MG. Affections in white shrimp cultures due to the white spot syndrome virus. Salud, Ciencia y Tecnología - Serie de Conferencias. 2024; 3:.110. https://doi.org/10.56294/sctconf2024.110
Enviado: 04-01-2024 Revisado: 29-07-2024 Aceptado: 09-12-2024 Publicado: 10-12-2024
Editor: Prof. Dr.
William Castillo-González ![]()
Autor para la correspondencia: Raúl González Salas *
ABSTRACT
Aquaculture is one of the economic activities that has shown increasing development at a global level over the years. Like other activities, this has been affected since the appearance of white spot disease (WSD), classified as a global shrimp epidemic and whose cause is the white spot syndrome virus (WSSV), which has been the most widespread in the shrimp sector and various other crustaceans throughout the world. The objective of the review was to analyze white spot disease, biological cycle, transmission, diagnosis and prevention measures, as a highly virulence agent that affects the white shrimp Litopenaeus vannamei. A descriptive bibliographic review study was carried out, at an exploratory level, through the search of scientific articles, books and government documents relevant to the topic. Research is currently being carried out to better understand its structure and act based on prevention.
Keywords: Effects; Transmission; Prevention.
RESUMEN
La acuicultura es una de las actividades económicas que a lo largo de los años ha presentado un desarrollo creciente a nivel global. Como otras actividades esta, se ha visto afectada desde la aparición de la enfermedad de la mancha blanca (WSD), catalogada como una epidemia mundial del camarón y cuya causa la constituye el virus del síndrome de la mancha blanca (WSSV), que ha sido el de mayor propagación en el sector del camarón y varios otros crustáceos en todo el mundo. La revisión tuvo como objetivo analizar la enfermedad de la mancha blanca, ciclo biológico, transmisión, diagnóstico y las medidas de prevención, como agente de gran virulencia que afecta al camarón blanco Litopenaeus vannamei. Se realizó un estudio de revisión bibliográfica descriptivo, de nivel exploratorio, a través de la búsqueda de artículos científicos, libros y documentos gubernamentales relevantes para la temática. Actualmente se realizan investigaciones para comprender mejor su estructura y actuar en función de la prevención.
Palabras clave: Afectaciones; Transmisión; Prevención.
INTRODUCCIÓN
La acuicultura parece ser una significativa alternativa para aumentar las contribuciones a la alimentación. Representa la más rápida creciente industria agrícola en algunos países. Este panorama global se refleja en países donde la acuicultura suministra alimentos de alta calidad a bajo costo a millones de personas, generar ingresos para la agricultura y hogares pesqueros y desempeñan un papel central en muchas economías locales y nacionales. Su contribución a la globalización con el suministro de varias especies de peces, crustáceos y moluscos aumentaron de 3,9 % de la producción total en peso en 1970 al 33 % en 2005, al 62,5 % en 2018 y se proyecta que la acuicultura alcance el 89 % en 2030.
En este sistema de producción alimentario, el virus del síndrome de la mancha blanca (WSSV), es el único miembro del género Whispovirus, familia Nimaviridae, tiene un gran genoma de ADN bicatenario y es uno de los patógenos virales más dañinos para los crustáceos. La infección por WSSV provoca la enfermedad de la mancha blanca (WSD) y la mortalidad masiva de crustáceos, lo que amenaza potencialmente la ecología marina y causa grandes pérdidas económicas a la industria del cultivo de camarón.(1) El camarón blanco del Pacífico, Penaeus vannamei (sinónimo, Litopenaeus vannamei), actualmente el camarón más cultivado en el mundo, es una especie representativa del subfilo Crustacea con un estado evolutivo importante. En los últimos años, el cultivo de P. vannamei se ha visto gravemente amenazado por el WSSV, por tanto es importante comprender el mecanismo patogénico de la infección por WSSV que es la clave para su control en la acuicultura.(2)
La enfermedad de la mancha blanca (WSD), ha sido catalogada como una epidemia mundial del camarón, causada por el virus del síndrome de la mancha blanca (WSSV), el cual se ha extendido a las principales áreas de cultivo de camarón de Asia y América,(3) lo que resultó en una gran mortalidad del huésped en un corto período de 3 a 10 días y, por lo tanto, el virus fue incluido como patógeno de declaración obligatoria por la Oficina Internacional de Epizootias (OIE). Algunas de las causas que han influido en su propagación se relaciona que para aumentar la producción de camarón se incrementó el uso de antibióticos,(4) desinfectantes y medicamentos veterinarios, y los efectos de su uso desmedido no solo causó resistencia al camarón, sino que también indujo contaminación ambiental, lo que amenaza gravemente la salud humana y el desarrollo sostenible de la industria del camarón.(5)
Después de la primera epidemia en 1992, la producción disminuyó en más del 70 %, lo que resultó en una pérdida de producción en tres años de más de 2 mil millones de dólares estadounidenses en China. Antes del brote de WSSV, la tasa de producción anual de Tailandia era de alrededor de 34 000 toneladas por año, pero en 1994 había caído a 26 000 toneladas. Indonesia siguió un patrón similar, con una producción que aumentó gradualmente hasta 17 000 toneladas por año de 1985 a 1991 hasta que se presentó el brote de WSSV, por lo que su producción cayó en 1992, resultando en pérdidas de producción proyectadas de casi mil millones de dólares durante un periodo de 10 años.(6)
En Ecuador, se produjo un brote en 1999 y la producción cayó más del 60 % en 2 años, lo que resultó en pérdidas de más de mil millones de dólares entre 1998 y 2001. Una situación similar se registró en Panamá y Perú, donde la producción disminuyó un 90 %, lo que resultó en pérdidas de más de 100 millones de dólares y 70 millones de dólares en 3 años, respectivamente. Desde 1992, los ingresos de la acuicultura de camarón en la India han disminuido a una pérdida de INR 2700 millones. En 1994, la enfermedad se expandió al área suroeste de Bangladesh, dañando aproximadamente el 90 % de las grandes granjas camaroneras y provocando una disminución del 20 % en la producción nacional de camarón. Como resultado, las exportaciones de camarón de Bangladesh cayeron de 25 742 toneladas en 1997-1998 a 18 630 toneladas.(7)
Algunas de las estrategias actuales de bioseguridad se utilizan para mantener las enfermedades fuera de los estanques de camarones, como la desinfección del agua de los estanques, la cuarentena de nuevas poblaciones antes de la siembra y el uso más amplio de camarones libres de patógenos específicos. La secuenciación y caracterización de varias cepas de WSSV ha proporcionado detalles sobre la biología y patogenicidad de este agente etiológico, conocimiento necesario para desarrollar métodos de control exitosos.(8)
En varios países productores de camarón de Asia y América, las infecciones producidas por el WSSV han tenido consecuencias socioeconómicas desastrosas. Como resultado del comercio internacional o la migración de especies enfermas, la Organización Mundial de Sanidad Animal reconoció que varias enfermedades representan un peligro sustancial para el camarón de cultivo. WSD está recibiendo mucha investigación científica debido a los posibles efectos económicos del virus. Actualmente se están realizando investigaciones para comprender mejor la biología molecular y la fisiopatología del WSSV, así como también los procedimientos para prevenir y tratar esta enfermedad viral. Sin embargo, se deben realizar más estudios en países con especies hospedadoras más resistentes para comprender su papel en la mitigación de los impactos de las enfermedades, ya que estas revelaciones pueden ayudar a desarrollar un tratamiento para la WSD.(9) La presente revisión tuvo como objetivo analizar la enfermedad de la mancha blanca, ciclo biológico, transmisión, diagnóstico y las medidas de prevención, como agente de gran virulencia que afecta al camarón blanco Litopenaeus vannamei.
MÉTODO
Se realizó un estudio de revisión bibliográfica de tipo descriptivo, de nivel exploratorio con enfoque cualitativo, a través de la búsqueda de artículos científicos y libros relacionados con la temática del cultivo del camarón y la enfermedad de la mancha blanca (WSD). La búsqueda bibliográfica abarcó el período de 2010 a 2023. Los criterios de inclusión se basaron en publicaciones ISI/Scopus en las bases de datos WoS (Web of Science) y Scopus. Los registros se identificaron primero mediante la búsqueda de datos, seguida de la eliminación de duplicados y artículos de revistas no indexadas.
El último paso fue la selección de los estudios que se incluyeron en la revisión sobre la base de los artículos que pasaron la evaluación de elegibilidad. La búsqueda de esas publicaciones utilizó términos clave, como “Enfermedad de la mancha blanca (WSD)” “cultivo de camarón en estanques”, “enfermedades virales en camarones”, “cultivo de camarón en Ecuador”, “impactos del cambio climático en la pesca de camarón”, y también incluía artículos publicados por autores sobre las enfermedades virales en camarón blanco. El estudio utilizó una amplia revisión de la literatura en sincronía con las bases de datos de la Organización Mundial de Sanidad Animal (OMSA), información del Ministerio de Agricultura, Ganadería Acuacultura y Pesca de Ecuador.
La estrategia de búsqueda se centró en la recolección de 83 publicaciones de las cuales se aceptaron 26 artículos que cumplieron los criterios de inclusión mencionados, relacionados con la manifestación de la mancha blanca en el cultivo de camarón, revisiones sistemáticas y metaanálisis, libros y artículos publicados en español e inglés. Se descartaron 57 artículos que no clasificaron para los criterios de búsqueda, relativos a cartas al editor, artículos en base de datos regionales, y que no abordaban los aspectos relacionados al WSSV.
RESULTADOS
La importancia de la acuicultura de camarón y la gravedad de la enfermedad causada por el WSSV han llevado a un número creciente de estudios sobre las infecciones que ocasiona este patógeno en camarones. Estos estudios cubren una amplia gama de temas, incluyendo la identificación de huéspedes y/o portadores, modo de transmisión y tropismo tisular; caracterización de la morfología/ultraestructura del WSSV y virulencia;(10) continuando con el desarrollo de cultivos celulares primarios y líneas celulares para estudios de replicación de virus y ciclo de vida. Además de las técnicas biológicas tradicionales, recientemente se han empleado técnicas ómicas de alto rendimiento para estudiar el WSSV.(11)
Estos estudios incluyen investigaciones sobre el genoma del WSSV y cambios en los transcriptomas del camarón,(12) proteomas y metabolomas en respuesta a WSSV.(13) Se han realizado varios esfuerzos para desarrollar estrategias para el control del WSSV en la acuicultura, como la exposición previa a patógenos del camarón, el control ambiental (por ejemplo, cambios en la temperatura del estanque), tratamientos a base de hierbas y vacunación. A pesar de estos esfuerzos, no existen métodos de vacunación o quimioterapia consistentemente eficaces para controlar el virus y su propagación. Los métodos actuales más comunes para controlar el WSSV son las prácticas de cría, como los protocolos sanitarios de las granjas, el momento de la temporada de siembra, el uso de semillas libres de patógenos y el policultivo de camarones y peces. Sin embargo, ninguna de estas prácticas es completamente adecuada y se requiere más investigación para comprender mejor los mecanismos de infección por WSSV y sus efectos en el sistema inmunológico del camarón.(14)
Inicialmente, como baculovirus no ocluido, el WSSV se colocó en la subfamilia Nudibaculoviridae, perteneciente a la familia Baculoviridae. Sin embargo, fue reclasificado en una nueva familia denominada Whispoviridae.(15) Posteriormente, WSSV fue clasificado dentro de una nueva familia llamada Nimaviridae que contiene un solo género, Whispovirus, que contiene una sola especie: WSSV. Sin embargo, según publicaciones anteriores del Comité Internacional sobre Taxonomía de Virus (ICTV), indicó la inclusión de una sola especie (WSSV) en Nimaviridae, familia que fue reconocida como inusual porque algunos otros virus encontrados en varias especies de cangrejos han sido descritos como “similar” al WSSV, al menos según la morfología del virión. Por lo tanto, la posición taxonómica de esos virus se definió tentativamente como dentro de la familia Nimaviridae por el ICTV y aún esta posición está a la espera de evidencia más detallada acerca de esos virus.(16)
En la investigación realizada por Islam et al.(6), muestra la estructura del virus (figura 1) y analiza como el virión es un conjunto sofisticado de macromoléculas adaptadas para proteger y entregar ADN viral. Sus proteínas estructurales han sido muy importantes, ya que son las partículas principales que interactúan con el huésped, desempeñan funciones de orientación celular y estimulan la mayoría de las defensas. La secuencia genética en estos, debe caracterizarse para determinar la categorización taxonómica de un virus. La función estructural y la colaboración de las proteínas del virión del WSSV pueden aclarar los atributos morfológicos inusuales del virus. En varios estudios se han reconocido proteínas del WSSV. Las proteínas no estructurales se han distinguido por estar involucrados con la regulación transcripcional (VP9), multiplicación viral (WSV 021) así como ADN regulación de replicación (WSV 477).
El virus del síndrome de la mancha blanca se puede transmitir por rutas horizontales y verticales, por lo que la transmisión del virus entre el camarón y otros crustáceos decápodos puede producirse por tres vías, a saber:
• Vía oral, alimentándose de los organismos infectados o comida contaminada. Además, la transmisión del virus es también posible mediante el consumo de tejido infectado por depredación y canibalismo,
• A través del agua en la que el virus invade a través de branquias y otras superficies del cuerpo, con exposición directa a partículas de virus en el agua,
• Mediante la transmisión vertical, en la que el virus pasa de un reproductor infectado a la descendencia a través de ovocitos. Diferentes hallazgos han demostrado que la tasa de transmisión son similares en ambas especies de P. vannamei y P. monodon.(17)
La estructura de una nucleocápside de WSSV se ha dibujado basándose en la información proporcionada en la sección morfológica (figura 2). En (a) se muestra la nucleocápside del WSSV, que tiene 15 hélices verticales prominentes, se examinó mediante microscopía electrónica. En (b) una sección transversal de una sola nucleocápside, hélices con un diámetro de 70 nm (vista lateral). La (c) representa una nucleocápside vacía (sección transversal) que tiene un diámetro de 80 nm (vista lateral). La nucleocápside con la estructura rayada es una característica distintiva de identificación del WSSV.
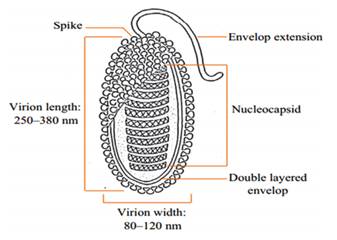
Fuente: Islam et al.(6)
Figura 1. Estructura del WSSV
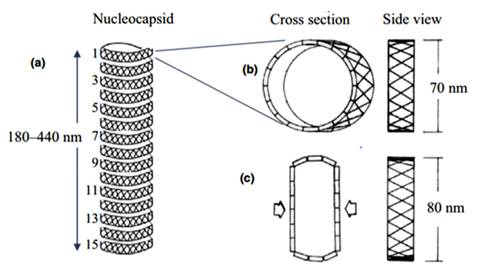
Fuente: Islam et al.(6)
Figura 2. Estructura de una nucleocápside de WSSV
El WSSV tarda mucho en manifestarse y, si lo hace, los animales infectados mueren entre 3 y 8 días, lo que lleva a una mayor tasa de letalidad. Los camarones infectados con WSSV se reúnen al costado del estanque en el ambiente natural y muestran signos patológicos 1 o 2 días antes de que ocurra cualquier muerte. Dentro de los 10 días siguientes al inicio de la enfermedad, la muerte acumulada puede exceder el 100 %. Los camarones juveniles de todas las edades y tamaños son patógenos en los estanques de engorde, pero se produce una mortalidad significativa 1 o 2 meses después de la siembra. El signo más común de infección por WSSV (figura 3) es la aparición de manchas blancas circulares o parches de 0,5 a 3,0 mm de diámetro, especialmente notables en la cutícula del cefalotórax y la sección de la cola. Blanco a marrón rojizo/rojizo/rosado/hasta decoloración son algunas de las características de la infección por WSSV; sobre la cabeza y caparazón, reducción de actividades de acicalamiento, reducción del consumo de alimentos, se torna floja la cutícula y decoloración del hepatopáncreas, baja respuesta al estímulo, falta de apetito, hinchazón de branquias debido a la acumulación de líquido y adelgazamiento y retraso en la coagulación de la hemolinfa, congregación cerca del embarque y otros síntomas que no son exclusivos del síndrome bacteriano de la mancha blanca.(17,24)

Fuente: Lee et al.(18)
Figura 3. Síntomas externos de mancha blanca que indican infección por el virus del síndrome de la mancha blanca (WSSV)
Los objetivos ectodérmicos y mesodérmicos para la transmisión del WSSV incluyen la piel, branquias, glándula antenal, intestino posterior, intestino anterior, gónadas, hematopoyético células, órgano linfoide y células ligadas al sistema nervioso. Células epiteliales de órganos endodérmicos, como aquellos en el hepatopáncreas, ciegos del intestino medio anterior y posterior y tronco del intestino medio, son resistentes a la infección por WSSV. Los epitelios del estómago, las branquias y el tegumento pueden sufrir lesiones importantes en las últimas etapas de la enfermedad. Esto podría resultar en varios mal funcionamiento de órganos y muerte en el peor de los casos. Aún no se han descubierto las vías por las cuales el WSSV ingresa al camarón. En los estudios se han descubierto variaciones en los sitios de entrada. Sin embargo, in situ la hibridación demostró que las ubicaciones más comunes de WSSV en juveniles tempranos de P. monodon fue epitelial subcuticular, células del estómago y células de las branquias, tegumento y conjuntivo, tejido del hepatopáncreas (tras la exposición al sistema operativo utilizando tejido dañado por WSSV)(6)
La expresión de una decoloración de color blanco a marrón rojizo puede aparecer sobre la cabeza y el caparazón de los animales infectados y la presencia de manchas blancas calcificadas en el exoesqueleto. La presencia de manchas blancas circulares, a su vez se pueden detectar parches en la cutícula del cefalotórax y parte de la cola de los camarones infectados. La presencia de manchas calcificadas en el exoesqueleto de un animal infectado (figura 4) puede tomarse como prueba y a su vez evidencia del diagnóstico para la enfermedad en condiciones de campo. Sin embargo, este signo clínico generalmente se observa en algunos, pero no en todas las especies que son huéspedes.(17)

Fuente: Dey et al.(17)
Figura 4. Camarón P. monodon infectado con WSSV, que indica síntomas de mancha blanca. (a) Manchas blancas en el caparazón. (b) Manchas blancas en el último segmento abdominal
Gholamhosseini et al.,(19) refieren que la tecnología de diagnóstico del WSSV está evolucionando desde la identificación inicial basada en la morfología hacia tecnologías inmunológicas y moleculares más sensibles que pueden detectar virus, incluso en portadores asintomáticos, mediante microscopía electrónica (EM). Entre varios métodos de diagnóstico, la PCR se utiliza como el método más sensible para detectar la infección por WSSV, al atacar el gen VP28. Hay varios métodos de PCR disponibles para el diagnóstico de WSSV, como la PCR de un solo paso, la PCR anidada y la PCR en tiempo real. La PCR de un solo paso se puede utilizar para detectar la presencia de WSSV en camarones con altos niveles de infección, y la PCR anidada puede aumentar el nivel de sensibilidad en comparación con la de un solo paso para detectar niveles bajos de infección en los reproductores y nauplios, postlarvas y juveniles.
Por lo tanto, el patógeno puede detectarse fácilmente mediante PCR de un solo paso cuando aparecen signos clínicos como letargo, alimentación reducida y manchas blancas en el exoesqueleto, pero solo puede detectarse mediante PCR anidada cuando es asintomático. Además, la PCR en tiempo real es una técnica fiable mediante la cual se ejecuta todo el análisis en tiempo real mediante la detección y cuantificación del número de copias del virión WSSV.(19)
El estudio histológico a través de la técnica de hematoxilina y eosina (H & E) es un método de diagnóstico importante que se utiliza para verificar la infección por WSSV en camarones. El diagnóstico histológico (figura 4), después de la infección por WSSV permite analizar la estructura de los tejidos, especialmente se recomiendan los de origen mesodérmico y ectodérmico, como branquias, órganos linfoides, epitelio cuticular y tejidos conectivos subcuticulares, observándose los núcleos infectados agrandados y con cromatina alienada, a su vez contienen cuerpos de inclusión con eosinófilos fuertemente teñidos en las primeras etapas de la infección y basófilos en el caso de infecciones más avanzadas.(19)
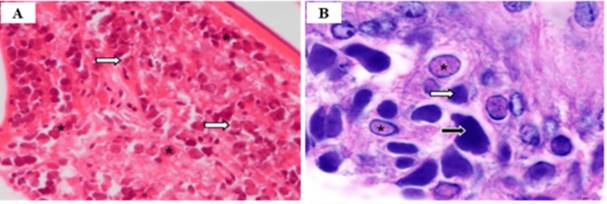
Fuente: Gholamhosseini et al.(19)
Figura 4. Penaeus vannamei infectado con el virus del síndrome de la mancha blanca (WSSV). La infección progresa a través de diferentes etapas, que se pueden observar en el núcleo mediante histología
En la figura (A) se muestra que las células infectadas en etapa temprana muestran núcleos agrandados con cromatina marginada y una región central eosinófila homogénea. En (B) la inclusión eosinófila generalmente se expande para llenar el núcleo. Esta inclusión se vuelve basófila al teñirse y de color más denso a medida que avanza la infección (flecha blanca). Luego, los núcleos se desintegran para que el contenido se fusione con el citoplasma (flecha negra). Barra de escala = 10 µm. tinción H y E.
WSSV tiene un impacto económico significativo en la acuicultura en todo el mundo. Después de la primera epidemia en 1992, la producción disminuyó más del 70 %, lo que resultó en una pérdida de producción en tres años de más de 2 mil millones de dólares estadounidenses en China. Estudios reflejan que antes del brote de WSSV, la producción anual de Tailandia era de alrededor de 34 000 toneladas por año, pero en 1994 había caído a 265 000 toneladas, por un valor de 1 600 millones de dólares. Indonesia siguió un patrón similar, con una producción que aumentó gradualmente hasta 17 000 toneladas por año de 1985 a 1991 hasta el brote de WSSV, debido al WSSV, su producción cayó en 1992, lo que dio lugar a pérdidas de producción proyectadas de casi mil millones de dólares en los próximos 10 años. En Ecuador se produjo un brote en 1999, y la producción cayó más del 60 % en 2 años, lo que resultó en pérdidas de más de mil millones de dólares entre 1998 y 2001. Una situación similar se registró en Panamá y Perú, donde la producción disminuyó en un 90 %, lo que resultó en pérdidas de más de 100 millones de dólares y 70 millones de dólares más de 3 años, respectivamente. Desde 1992, los ingresos de la acuicultura de camarón en la India han disminuido a una pérdida de INR 2700 millones. En 1994, la enfermedad se expandió al área suroeste de Bangladesh, dañando aproximadamente el 90 % de las grandes granjas camaroneras y generando una disminución del 20 % en producción nacional de camarón. Como resultado, las exportaciones de camarón de Bangladesh cayeron de 25 742 toneladas en 1997-1998 a 18 630 toneladas.(6)
En entrevista con algunos pobladores pesqueros, estos manifiestan que el virus de WSSV desde su aparición, le ha provocado varias pérdidas al no poder comercializar la misma cantidad de camarones y otros que logran pescar, lo que en igual medida ocurre en la cría mediante estanques. Con frecuencia encuentran camarones ya afectados entre la población o estos aparecen unos días después de la captura. Años anteriores era difícil encontrar camarones con estas afectaciones, pero desde la aparición del virus resulta bastante frecuente su aparición. Ellos consideran que han podido contar con información sobre el virus y sus principales formas de manifestación, lo que les ha permitido un diagnóstico más certero y la adopción de medidas ante su aparición.
DISCUSIÓN
La enfermedad por WSSV puede afectar a una amplia variedad de crustáceos, por lo que las poblaciones naturales de estos huéspedes también pueden servir como reservorio del agente infeccioso. Dada la gravedad de la WSD en crustáceos en cautiverio, no es sorprendente que se hayan realizado muchos esfuerzos para descubrir las causas fundamentales de la enfermedad y encontrar posibles tratamientos para controlarla o mitigarla.
Los camarones cultivados tienen una vida útil máxima de 4 a 5 meses, tolerando en determinadas circunstancias variaciones fisicoquímicas extremas en los estanques de cultivo, incluidas fluctuaciones de temperatura y salinidad. Las salinidades excesivas son un factor de estrés ambiental importante, que puede aumentar la susceptibilidad del camarón a enfermedades virales.(20) Además, los marcadores genéticos resultantes de mutaciones podrían ser una posible causa del error de diagnóstico molecular debido a la interferencia de la unión del cebador de la PCR, lo que podría dar lugar a productos de PCR no específicos o resultados negativos incorrectos de la PCR, lo que limitaría la utilidad de los agentes terapéuticos basados en la PCR. A pesar de los obstáculos que plantean sus genotipos únicos y el proceso de infección, que difiere significativamente del de otros virus, se ha avanzado mucho en la investigación del WSSV.(21)
Como parte de la vigilancia epidemiológica y acciones recuperativas la industria camaronera se ha propuesto gestionar la salud de las especies de camarón cultivadas y desarrollar nuevos métodos para la prevención y el tratamiento de enfermedades, prevenir el movimiento transfronterizo ilegal de especies de camarón vivo y controlar los brotes de enfermedades mediante el suministro de alimentos frescos en todo el mundo, labor que requiere un inmenso esfuerzo.(21, 22)
Para abordar estas cuestiones, Lee et al.,(23) sugirió lo siguiente:
• El desarrollo de semillas de camarón SPF (Specific Pathogen Free o Libre de Patógenos Específicos)
• Uso generalizado y estandarización de pruebas de diagnóstico
• Desarrollo de técnicas de reproducción aplicadas desde el punto de vista de la bioseguridad
• Esfuerzos de control para reducir el riesgo de transmisión de enfermedades a través del movimiento transfronterizo
• Investigaciones sobre la eficacia de inmunoestimulantes y vacunas
• Una comprensión completa de la especificidad de las especies de camarón por patógeno
• Desarrollo de estudios epidemiológicos de las enfermedades del camarón
• Estudios de ecología molecular para el control de microorganismos patógenos en criaderos y zonas de reproducción de camarón
• Realizar pruebas de virus mediante estrictos procedimientos de cuarentena transfronterizos
• Restringir las importaciones indiscriminadas de crustáceos exóticos.
Algunas investigaciones apuntan a que las medidas de bioseguridad incluyen selección de reproductores libres de patógenos específicos, secado completo de los tanques de cultivo después de la cosecha, sistemas de bajo intercambio de agua como el modelo RAS, restricción del acceso a vectores y patógenos (a través de cercas para cangrejos, bloqueo de aves y baños de pies en camarones colocados en la entrada a la granja) y mejorar la resistencia a enfermedades (inmunoestimulantes, neutralización, manejo ambiental y vacunas) en camarones son métodos de manejo efectivos, ya que actualmente no hay manera de tratar la infección por WSSV.
Aunque desde finales de la década de 1990 ha sido cada vez más evidente que la aparición del WSSV en un sistema acuático no siempre presagia una tragedia. Los cambios ambientales, probablemente relacionados con el estrés osmótico a través de concentraciones de sal o dureza, o fluctuaciones abruptas de temperatura, han generado brotes de portadores latentes a la especie P. monodon en Tailandia.(21)
Asimismo, en América Latina y América del Norte, se demostró que las fluctuaciones de temperatura causaban la muerte del P. vannamei infectado. Sin embargo, se han realizado otros estudios que refieren implicación de la temperatura ambiente que, según se ha revelado, limita la tasa de mortalidad del WSSV a temperaturas de 18 o 22 °C y provoca el 100 % de muertes a 32 °C en los Estados Unidos, pero induce mortalidad a menos de 30 °C, y prevenirlo a temperaturas significativamente superiores a 30°C en Ecuador. En consecuencia, los 3 a 4 años de trabajo transcurridos en acciones de evaluación genética en poblaciones nacionales de P. vannamei (selección de camarones que sobrevivieron a brotes de WSSV) parecen haber mejorado la resistencia al WSSV en Ecuador. Desde el brote del WSSV en 1999, en América Central y del Sur, los sectores culturales de P. vannamei se han ido reconstruyendo constantemente.(21)
CONCLUSIONES
El virus del síndrome de la mancha blanca sigue siendo el patógeno más importante en la producción del camarón, es por ello que las investigaciones se han centrado en lograr una mejor comprensión de la biología, la patología del WSSV y la adecuada secuenciación genética, tratamiento y prevención. Sin embargo, se deberían realizar otros estudios relacionados a los organismos huéspedes más resistentes para comprender los mecanismos de resistencia.
El movimiento transfronterizo legal o ilegal de especies acuáticas vivas para la acuicultura ha acelerado la propagación de enfermedades y la demanda de vacunas y terapias para su prevención. Sin embargo, para encontrar una solución fundamental, se necesitan varios estudios sobre la etiología de estas enfermedades, y se requerirán métodos de cría en la acuicultura que sean respetuosos con los organismos, que tengan en cuenta el bienestar animal, como el mantenimiento de una densidad de cría adecuada y un entorno de cría limpio, utilizando SPF (libre de patógenos específicos) o SPR (resistencia a patógenos específicos), y así lograr una industria de cultivo de camarón sostenible y libre de enfermedades.
REFERENCIAS BIBLIOGRÁFICAS
1. Suryakodi, S., Nafeez, A., Badhusha, A., Santhosh, S., Sivakumar, S., Abdul, S., Sahul, A. S. First report on the occurrence of white spot syndrome virus, infectious myonecrosis virus and Enterocytozoon hepatopenaei in Penaeus vannamei reared in freshwater systems Journal of Fish Diseases [Internet]. 2022. [Consultado 22 feb 2023]; 45(5): 699-706. Disponible en: https://doi.org/10.1111/jfd.13595
2. Yang, L., Wang, Z. A., Geng, R., Deng, H., Niu, S., Zuo, H., Xu, X. White Spot Syndrome Virus (WSSV) Inhibits Hippo Signaling and Activates Yki To Promote Its Infection in Penaeus vannamei. Microbiology Spectrum [Internet]. 2023. [Consultado 11 marzo 2024]; 11(1): e02363-22. Disponible en: https://journals.asm.org/doi/full/10.1128/spectrum.02363-22
3. Prochaska, J., Poompuang, S., Koonawootrittriron, S., Sukhavachana, S., Na-Nakorn, U. Evaluation of a commercial SPF Litopenaeus vannamei shrimp breeding program: Resistance to infectious myonecrosis virus (IMNV), Taura syndrome virus (TSV), and white spot syndrome virus (WSSV) from laboratory challenges. Aquaculture [Internet]. 2022 . [Consultado 17 jun 2023]; 554: 738145. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0044848622002617
4. González, R., Vidal del Río, M.M, Pimienta, I. Uso intensivo de antibióticos profilácticos en la acuicultura: un problema creciente para la salud humana y animal. Universidad y Sociedad [Internet]. 2021. [Consultado 23 oct 2023];13(S2):204-10. Disponible en: https://rus.ucf.edu.cu/index.php/rus/article/view/2304
5. Edeh, I. C., Nsofor, C. I. Utilization of antibiotics in aquaculture; Present status and future alternatives in the post COVID-19 pandemic era. The Bioscientist Journal [Internet]. 2023. [Consultado 23 ene 2024]; 11(1): 57-70. Disponible en: http://bioscientistjournal.com/index.php/The_Bioscientist/article/view/139/144
6. Islam, S. I., Mou, M. J., Sanjida, S., Mahfuj, S. A review on molecular detection techniques of white spot syndrome virus: Perspectives of problems and solutions in shrimp farming. Veterinary Medicine and Science [internet]. 2023. [Consultado 13 feb 2024]; 9(2): 778-801. Disponible en: https://onlinelibrary.wiley.com/doi/epdf/10.1002/vms3.979
7. Dey, B. K., Dugassa, G. H., Hinzano, S. M., Bossier, P. Causative agent, diagnosis and management of white spot disease in shrimp: A review. Reviews in Aquaculture [Internet]. 2020. [Consultado 24 nov 2022]; 12(2): 822-865. Disponible en: https://onlinelibrary.wiley.com/doi/epdf/10.1111/raq.12352
8. Oakey, J., Smith, C., Underwood, D., Afsharnasab, M., Alday, V., Dhar, A., Sivakumar, S., Sahul, A. S., Beattie, K., Crook, A. Global distribution of white spot syndrome virus genotypes determined using a novel genotyping assay. Archives of Virology [Internet]. 2019. [Consultado 18 nov 2022]; 164(1): 2061-2082. Dispoible en: https://link.springer.com/article/10.1007/s00705-019-04265-2
9. Pan, X., Zhang, Y., Sha, X., Wang, J., Li, J., Dong, P., Liang, X. Highly sensitive detection of low-abundance white spot syndrome virus by a pre-amplification PCR method. Journal of Microbiology and Biotechnology [Internet]. 2017. [Consultado 22 dic 2019]; 27(3): 471–479. Disponible en: https://koreascience.kr/article/JAKO201713647762268.page
10. Li, L., Hong, Y., Huo, D., Cai, P. Ultrastructure analysis of white spot syndrome virus (WSSV). Arch. Virol [Internet]. 2020. [Consultado 9 jul 2022]; 165(1): 407–412. Disponible en: https://link.springer.com/article/10.1007/s00705-019-04482-9
11. Ning, M., Wei, P., Shen, H., Wan, X., Jin, M., Li, X., Shi, H., Qiao, Y., Jiang, G., Gu, W., Wang, W., Wang, L., Meng, Q. Proteomic and metabolomic responses in hepatopancreas of whiteleg shrimp Litopenaeus vannamei infected by microsporidian Enterocytozoon hepatopenaei. Fish Shellfish Immunol [Internet]. 2019. [Consultado 12 may 2022]; 87(1): 534–545. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S1050464819300683
12. Peruzza, L., Thamizhvanan, S., Vimal, S., Vinaya Kumar, K., Shekhar, M.S., Smith, V.J., Hauton, C., Vijayan, K.K., Sahul Hameed, A.S. A comparative synthesis of transcriptomic analyses reveals major differences between WSSV-susceptible Litopenaeus vannamei and WSSV-refractory Macrobrachium rosenbergii. Dev. Comp. Immunol [Internet]. 2020. [Consultado 7 agost 2022]; 104(1): 103564. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0145305X19303337
13. Tao, M., Zhou, H., Luo, K., Lu, J., Zhang, Y., Wang, F., 2019. Quantitative serum proteomics analyses reveal shrimp responses against WSSV infection. Dev. Comp. Immunol [Internet]. 2019. [Consultado 21 jul 2023]; 93(1): 89–92. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0145305X18305536
14. Alfaro, A. C., Nguyen, T. V., Bayot, B., Leon, J. A. Domínguez, C., Sonnenholzner, S. Metabolic responses of whiteleg shrimp to white spot syndrome virus (WSSV). Journal of invertebrate pathology [Internet]. 2021. [Consultado 15 mar 2023]; 180(1): 107545. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0022201121000124
15. Gholamhosseini, A., Mohammadi, A., Akbari, S., Banaee, M. Molecular, histopathologic and electron microscopic analysis of white spot syndrome virus in wild shrimp (Fenneropenaeus indicus) in the coastal waters of Iran. Archives of Virology [Internet]. 2020. [Consulato 24 nov 2023]; 165(1): 1433-1440. Disponible en: https://link.springer.com/article/10.1007/s00705-020-04625-3
16. Wang, J., Huang, Y., Xu, K., Zhang, X., Sun, H., Fan, L., Yan, M. White spot syndrome virus (WSSV) infection impacts intestinal microbiota composition and function in Litopenaeus vannamei. Fish & shellfish immunology [Internet]. 2019. [Consultado 29 may 2022]; 84(1): 130-137. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S105046481830620X
17. Dey, B. K., Dugassa, G. H., Hinzano, S. M., Bossier, P. Causative agent, diagnosis and management of white spot disease in shrimp: A review. Reviews in Aquaculture [Internet]. 2020. [Consultado 19 jun 2022];12(2):822-65. Disponible en: https://onlinelibrary.wiley.com/doi/abs/10.1111/raq.12352
18. Lee, D., Yu, Y. B., Choi, J. H., Jo, A. H., Hong, S. M., Kang, J. C., Kim, J. H. Viral shrimp diseases listed by the OIE: a review. Viruses [Internet]. 2022. [Consultado 16 oct 2023]; 14(3): 585. Disponible en: https://www.mdpi.com/1999-4915/14/3/585
19. Gholamhosseini, A.; Mohammadi, A.; Akbari, S.; Banaee, M. Análisis molecular, histopatológico y microscópico electrónico del virus del síndrome de la mancha blanca en camarones silvestres (Fenneropenaeus indicus) en las aguas costeras de Irán. Arco. Virol [Internet]. 2020. [Consultado 11 dic 2023]: 165(1): 1433–1440. Disponible en: http://eprints.uanl.mx/1964/1/1080051923.pdf
20. Abad, S., Frías, M., Romero, O., Lozano, R., Garcia, A., Montoya, L., Voltolina, D. White spot syndrome virus (WSSV) infection and immunity responses in white shrimp (Litopenaeus vannamei) exposed to sublethal levels of metals. Aquaculture Research [Internet]. 2019. [Consultado 26 oct 2022]; 50(3): 758–764. Disponible en: https://onlinelibrary.wiley.com/doi/epdf/10.1111/are.13932
21. Islam, S. I., Mou, M. J., Sanjida, S., Mahfuj, S. A review on molecular detection techniques of white spot syndrome virus: Perspectives of problems and solutions in shrimp farming. Veterinary Medicine and Science [Internet]. 2023. [Consultado 23 feb 2024]; 9(2): 778-801. Disponible en: https://onlinelibrary.wiley.com/doi/epdf/10.1002/vms3.979
22. Arulmoorthy, M. P., Anandajothi, E., Vasudevan, S., Suresh, E. Major viral diseases in culturable penaeid shrimps: a review. Aquaculture International [Internet] 2020. [Consultado 13 oct 2023]; 28(1): 1939-1967. Disponible en: https://link.springer.com/article/10.1007/s10499-020-00568-3
23. Lee, D., Yu, Y. B., Choi, J. H., Jo, A. H., Hong, S. M., Kang, J. C., Kim, J. H. Viral shrimp diseases listed by the OIE: a review. Viruses [Internet]. 2022. [Consultado 16 oct 2023]; 14(3): 585. Disponible en: https://www.mdpi.com/1999-4915/14/3/585
24. Espinoza Lastra OR, Suárez Espinosa EE, Alarcón López FM. Análisis de la hipersexualización de menores derivada del tipo de contenidos presentes en los medios de comunicación a gran escala. Dilemas contemp: educ política valores [Internet]. 2024 [cited 2024 Sep 14]; Available from: https://dilemascontemporaneoseducacionpoliticayvalores.com/index.php/dilemas/article/view/4037
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo de la presente investigación.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Raúl González Salas, Darwin Rafael Villamarín Barragán, Marcelo Alejandro Jiménez Villa, Matías Gabriel Jaramillo López.
Curación de datos: Raúl González Salas, Darwin Rafael Villamarín Barragán, Marcelo Alejandro Jiménez Villa, Matías Gabriel Jaramillo López.
Análisis formal: Raúl González Salas, Darwin Rafael Villamarín Barragán, Marcelo Alejandro Jiménez Villa, Matías Gabriel Jaramillo López.
Investigación: Raúl González Salas, Darwin Rafael Villamarín Barragán, Marcelo Alejandro Jiménez Villa, Matías Gabriel Jaramillo López.
Metodología: Raúl González Salas, Darwin Rafael Villamarín Barragán, Marcelo Alejandro Jiménez Villa, Matías Gabriel Jaramillo López.
Administración del proyecto: Raúl González Salas, Darwin Rafael Villamarín Barragán, Marcelo Alejandro Jiménez Villa, Matías Gabriel Jaramillo López.
Validación: Raúl González Salas, Darwin Rafael Villamarín Barragán, Marcelo Alejandro Jiménez Villa, Matías Gabriel Jaramillo López.
Visualización: Raúl González Salas, Darwin Rafael Villamarín Barragán, Marcelo Alejandro Jiménez Villa, Matías Gabriel Jaramillo López.
Redacción – borrador original: Raúl González Salas, Darwin Rafael Villamarín Barragán, Marcelo Alejandro Jiménez Villa, Matías Gabriel Jaramillo López.
Redacción – revisión y edición: Raúl González Salas, Darwin Rafael Villamarín Barragán, Marcelo Alejandro Jiménez Villa, Matías Gabriel Jaramillo López.