Categoría: Health Sciences and Medicine
ORIGINAL
Prevalence of parasitosis and its influence on the intestinal microbiota of school children from rural communities in the province of Chimborazo, Ecuador
Prevalencia de parasitosis y su influencia en la microbiota intestinal de niños escolares de comunidades rurales de la provincia de Chimborazo, Ecuador
Sandra Noemí Escobar Arrieta1,2 ![]() *, Verónica Mercedes Cando Brito1,2
*, Verónica Mercedes Cando Brito1,2 ![]() *, Hugo Javier Sánchez-Moreno3
*, Hugo Javier Sánchez-Moreno3 ![]() *, Yolanda Verónica Buenaño Suárez4
*, Yolanda Verónica Buenaño Suárez4 ![]() *, Jhoana Lamiña Cali5
*, Jhoana Lamiña Cali5 ![]() *, Breidy Lamiña Cali5
*, Breidy Lamiña Cali5 ![]() *, Andrea Nataly Donoso Barba5
*, Andrea Nataly Donoso Barba5 ![]() *
*
1Grupo de investigación Leishmaniosis y otras parasitosis en Ecuador, Riobamba, Ecuador.
2Carrera de Bioquímica y Farmacia, Facultad de Ciencias, Escuela Superior Politécnica de Chimborazo, Riobamba, Ecuador.
3Escuela Superior Politécnica de Chimborazo, Riobamba, Ecuador.
4Laboratorio Clínico Domelab.
5Farmacia Pharmes.
Citar como: Escobar Arrieta SN, Cando Brito VM, Sánchez-Moreno HJ, Buenaño Suárez YVS, Lamiña Cali J, Lamiña Cali B, Donoso Barba AN. Prevalence of parasitosis and its influence on the intestinal microbiota of school children from rural communities in the province of Chimborazo, Ecuador. Salud, Ciencia y Tecnología - Serie de Conferencias. 2023; 2:636. https://doi.org/10.56294/sctconf2023636
Enviado: 30-06-2023 Revisado: 15-09-2023 Aceptado: 26-12-2023 Publicado: 27-12-2023
Editor: Dr.
William Castillo-González ![]()
ABSTRACT
Introduction: parasitosis is an infectious disease that puts the life of patients at risk, with higher prevalence in vulnerable groups, such as the infant population. Objective: For this reason, the present research aims to indicate the influence of parasites in the intestinal microbiota of Ecuadorian infants.
Methods: the sample population consisted of 264 boys and girls, aged 5 to 10 years, belonging to rural communities of Chimborazo, Ecuador. Stool samples were collected for analysis by the coproparasitic examination technique, and for confirmation of results, 8 % of the total samples were analyzed by the Willis flotation concentration method. For the determination of microbiota, massively parallel NGS sequencing was performed, and statistical analysis was performed by chi-square to determine risk factors.
Results: the prevalence of parasitosis in children was 44,32 %, the most prevalent species being: Entamoeba coli (58,86 %), Entamoeba histolytica (17,72 %), and Giardia lamblia (10,13 %). The presence of Trichuris trichiura eggs was identified by the Willis flotation method. The risk factors for intestinal parasitosis in the study population were: contact with pets, decay in the sanitary service infrastructure, lack of hygienic habits and garbage collection. The most prevalent bacterial population of the intestinal microbiota are: Prevotellaceae (55 %), Proteobacteria (47 %), Firmicutes (27 %), and Treponema (17 %).
Conclusion: there is a significant relationship between predisposing factors and intestinal parasitosis, and it directly affects intestinal symbiosis.
Keywords: Child; Intestinal Diseases; Gastrointestinal Microbiome; Metagenomics.
RESUMEN
Introducción: la parasitosis es una enfermedad infecciosa que pone en riesgo la vida de los pacientes, con mayor prevalencia en grupos vulnerables, como la población infantil.
Objetivo: es por ello que la presente investigación tiene como objetivo indicar la influencia de los parásitos en la microbiota intestinal de infantes ecuatorianos.
Métodos: la población muestral fue de 264 niños y niñas, en edades comprendidas de 5 a 10 años, pertenecientes a las comunidades rurales de Chimborazo, Ecuador. Se receptaron muestras de heces fecales para ser analizadas mediante técnica de examen coproparasitario, y para confirmación de resultados se analizó el 8 % del total de muestras mediante método de concentración por flotación de Willis. Para la determinación de microbiota, se realizó la secuenciación masiva paralela NGS, y el análisis estadístico mediante chi-cuadrado para la determinación de factores de riesgo.
Resultados: la prevalencia de parasitosis en niños fue del 44,32 %, siendo las especies más prevalentes: Entamoeba coli (58,86 %), Entamoeba histolytica (17,72 %), y Giardia lamblia (10,13 %). Mediante el método de flotación de Willis se identificó la presencia de huevos Trichuris trichiura. Los factores de riesgo de la parasitosis intestinal en la población de estudio fueron: contacto con mascotas, decadencia en la infraestructura de servicio higiénico, la falta de hábitos higiénicos y recolección de basura. La población de bacterias más prevalentes de la microbiota intestinal son: Prevotellaceae (55 %), Proteobacterias (47 %), Firmicutes (27 %), y Treponema (17 %).
Conclusión: existe relación significativa entre los factores predisponentes y la parasitosis intestinal, y directamente afecta a la simbiosis intestinal.
Palabras claves: Niños Escolares; Parasitosis Intestinal; Microbiota Intestinal; Metagenómica; Examen Coproparasitario.
INTRODUCCIÓN
La flora intestinal del ser humano es específica para cada individuo, aunque compartamos la mitad de los casi 600 000 genes que tenemos en ella.(1) Las infecciones intestinales producidas por agentes patógenos representan un problema de salud pública a nivel mundial. Los niños poseen mayor incidencia a las infecciones gastrointestinales, estas enfermedades afectan a la composición de la flora intestinal comensal del ser humano y son indicadores de la decadencia en hábitos de higiene personal, factores ambientales, pobreza, entre otros.(2)
Según la Organización Mundial de la Salud (OMS), cerca de 46 millones de niños en edades comprendidas entre 1 y 14 años están riesgo de infección por parásitos, donde 33,3 millones son de edad escolar. En Latinoamérica, el nivel de prevalencia e incidencia es mayor que los países desarrollados, se estima que entre el 20 % y 50 % de parasitosis, dependiendo de los factores sociales y demográficos. En Venezuela, el 72,73 % de niños en edad de escolaridad presentan infecciones parasitarias, y el 22,73 % con poliparasitismo elevado.(3) En Ecuador, la prevalencia de parasitosis en comunidades rurales de la provincia del Azuay, es del 23,52 %, siendo mayor en varones.(4)
Un niño en etapa de escolaridad con infección parasitaria puede presentar trastornos intestinales, que incluye retrasos en el crecimiento, síndrome de fatiga crónica, deterioro cognitivo,(5) e incluso perforar el intestino y llegar a órganos sistémicos a través de la circulación sanguínea, causando abscesos hepáticos.(4) Así también, la disbiosis o alteración de la flora intestinal, causa graves consecuencias en el niño en etapa de escolaridad como: falta de concentración, problemas en el desarrollo cognitivo, síndrome de malabsorción, o incluso puede provocar cáncer colorrectal.(6) Generalmente, las infecciones intestinales en niños se deben al consumo de alimentos contaminados con bacterias o parásitos, y no han sido tratadas con medidas higiénicas.
MÉTODO
El estudio fue de tipo no experimental, debido a que no se controló ni manipuló ninguna variable, por esto es de tipo observacional para determinar el microbiota intestinal, y la prevalencia conjuntamente con los factores de riesgo de parasitosis en niños de las comunidades parroquia de Chimborazo. El trabajo fue aprobado por el Comité de Bioética de la Pontificia Universidad Católica del Ecuador (CEISH-PUCE, Código: MB-04-2023). Así también, se solicitó los permisos oportunos al presidente del GAD Municipal de la parroquia rural, para el ingreso a las comunidades, considerando una población de muestral de 264 niños en edades comprendidas de 5 a 10 años, pertenecientes a las comunidades rurales de la provincia de Chimborazo. En la recolección de datos fueron las muestras de heces fecales fueron receptadas en tres comunidades rurales, mismas que fueron colocadas en un cooler y transportadas hasta el laboratorio de parasitología de la Facultad de Ciencias, ESPOCH, donde se asignó una codificación numérica a cada una de las muestras, encuestas, consentimiento y asentimientos. Para la recolección de datos y muestras, se contó con la colaboración de los miembros del grupo de investigación LEISHPAREC.
Examen coproparasitario
Los reactivos empleados para el análisis fueron: suero fisiológico y lugol, además de materiales, tales como: placas cubre objetos, placas porta objetos, mondadientes y microscopio óptico. Se asignó un código numérico único para cada paciente, mismo número designado fue colocado en cada placa portaobjetos. Se aplicó una gota de suero fisiológico y lugol, sucesivamente con la ayuda de un mondadientes se tomó 0,1 - 0,3 gramos de muestra, mismo que fue homogenizado en suero fisiológico, y se observó en el microscopio con el lente 10X y 40X para confirmar la morfología parasitaria característica de cada especie.(7,8)
Método de flotación de Willis
Se preparó una la solución saturada de NaCl, posteriormente con un baja lenguas se colocó las muestras de heces en la solución hasta el punto de conseguir una mezcla homogénea. La solución se transfirió en los tubos de ensayo hasta llenarlos por completo, sucesivamente se colocó un porta objetos sobre los tubos de manera que haga contacto con el líquido, por aproximadamente 30 minutos. De esta manera, se consiguió que las formas parasitarias quedarán adheridos a las placas porta objetos, que por densidad flotan en la superficie del líquido. Se observó en el microscopio con el lente objetivo de 10X y para confirmar la morfología parasitaria con el lente 40X.(9)
Secuenciación masiva paralela NGS
De esta manera, para la extracción del ADN total, se tomó una muestra significativa de heces de seis puntos aleatorios. Continuamente, una masa aproximada de 0,25 gramos fue macerada mecánicamente con pistilo plástico durante 2 minutos a temperatura ambiente, hasta obtener una pasta y seguir con la extracción mecánica-química de ácidos nucleicos totales.(10) El ADN genómico total se llevó a dilución en agua libre de nucleasas, para ser cuantificado empleando un espectrofotómetro. Posteriormente, el ADN genómico fue aleatoriamente cortado en fragmentos pequeños y a su vez fueron añadidos adaptadores en los extremos 5´ y 3´, estos se alinearon al final de los adaptadores, y luego purificados. La librería final fue cargada en la flowcell donde los fragmentos de ADN se capturan por oligos complementarios a los adaptadores. Las lecturas o reads obtenidas fueron limpiadas, ensambladas, contabilizadas empleando un pipeline bioinformático. Las secuencias finales fueron identificadas mediante BLAST procariotas y eucariotas con la base de datos SILVA, con un índice de identidad de 99 %, y visualizan con discos de Krona.(10)
Análisis estadístico
Los factores de riesgo de la parasitosis analizados en la presente investigación, fueron analizados mediante el programa Microsoft Office Excel y MegaStat mediante el empleo de tablas de contingencia y un nivel de significancia menor o igual a 0,05. Además, se elaboraron las conclusiones de cada relación en base a los grados de libertad, y valor de chi-cuadrado calculado; para finalmente compararlo con el valor de chi-cuadrado crítico con 95 % de confianza, en base a tablas estadísticas.(11)
Consideraciones éticas
Se contó con la aprobación del Comité de Bioética de la Pontificia Universidad Católica del Ecuador (CEISH-PUCE) para la investigación con muestras de seres humanos. Para lo cual, se realizaron consentimiento, asentimientos informados para el representante legal y lo niños, finalmente se elaboraron protocolos con las consideraciones debidas para el desarrollo del proyecto de investigación. Así también, se solicitó los permisos oportunos en las comunidades rurales de Chimborazo, dando cumplimiento con la protección de datos y salvaguardando la información de la población en estudio.
RESULTADOS
Frecuencia de parasitosis intestinal
De los 264 pacientes estudiados, 117 muestras correspondían a niños con parasitosis intestinal (44,32 %) de acuerdo a la tabla 1; lo que indica un alto índice de infección a causa de estos microorganismos en niños en edades comprendidas de 5 a 10 años.
|
Tabla 1. Prevalencia de parasitosis en niños escolares |
||
|
Parasitosis |
Número de casos |
Porcentaje (%) |
|
Positivo |
117 |
44,32 |
|
Negativo |
147 |
52,27 |
|
Tipo de parasitosis |
||
|
Monoparasitosis |
68 |
58,12 |
|
Parasitosis mixta |
49 |
41,88 |
|
TOTAL |
264 |
100 |
Consecuentemente, 68 escolares estaba con infección parasitaria, es decir infección causada por una sola especie patógena, lo cual corresponde al 58,12 %; mientras que 49 niños tenían parasitosis mixta (41,88 %). De acuerdo a la tabla 2, del total de niños estudiados, se determinó que el 51,79 % presentó parasitosis intestinal; mientras que el género femenino, el 57,95 % estaba parasitado.
|
Tabla 2. Prevalencia de parasitosis según el género en niños entre 5 a 10 años |
||||
|
|
Parasitados |
% |
No Parasitados |
% |
|
Hombres |
29 |
51,79 |
44 |
78,57 |
|
Mujeres |
51 |
57,95 |
46 |
52,27 |
En relación a los datos presentados en la tabla 3, se observó que la especie parasitaria con mayor prevalencia en la población de estudio es Quiste de Entamoeba coli (58,86 %), seguidamente de Quistes de Entamoeba histolytica (17,72 %), Quistes de Giardia lamblia (10,13 %), Quistes de Chilomaxtix mesnilii, Huevos de Hymenolepis nana y Quistes de Iodamoeba bütschlii (3,16 %), Huevos de Trichuris trichiura (1,90 %), Huevos de Ascaris lumbricoides, Huevos de Enterobius vermicularis y Quistes de Endolimax nana (0,63 %) respectivamente.
|
Tabla 3. Frecuencia de especies parasitarias presentes |
||
|
Especie parasitaria |
Casos |
Porcentaje (%) |
|
Entamoeba coli |
93 |
58,86 |
|
Entamoeba histolytica |
28 |
17,72 |
|
Giardia lamblia |
16 |
10,13 |
|
Chilomastix mesnilii |
5 |
3,16 |
|
Hymenolepis nana |
5 |
3,16 |
|
Iodamoeba bütschlii |
5 |
3,16 |
|
Enterobius vermicularis |
1 |
0,63 |
|
Trichuris trichiura |
3 |
1,90 |
|
Ascaris lumbricoides |
1 |
0,63 |
|
Endolimax nana |
1 |
0,63 |
Cabe mencionar que existen especies consideradas como no patógenas, tales como Entamoeba coli y Iodamoeba bütschlii, sin embargo, no difieren de importancia clínica debido a que son marcadores de las condiciones de hacinamiento y déficit de buenos hábitos de higiene la población de estudio. Por otra parte, las demás especies: Entamoeba histolytica, Giardia lamblia, Trichuris trichiura, entre otras, comúnmente denominadas como patógenas.(12)
Identificación de parasitos mediante metodología de flotación de Willis
Se evidenció la presencia de metazoarios mediante el empleo de la técnica de flotación de Willis que por la diferencia de densidad los geohelmintos flotaron en la superficie del recipiente, evidenciando huevos de Trichuris trichiura con mayor frecuencia.
Factores predisponentes de la parasitosis intestinal en niños escolares
|
Tabla 4. Factores de la parasitosis intestinal en niños de zonas rurales de la provincia de Chimborazo |
|||
|
Características |
Valor p |
Frecuencia de parasitados (%) |
|
|
Convivencia con mascotas en el hogar |
Si No |
0,0149 |
23,92 21,96 |
|
Sanitarios |
Pozo séptico Letrina Alcantarillado |
3,58E-07 |
21,18 14,12 10,59 |
|
Infraestructura del hogar |
Choza Adobe Cemento armado |
0,90 |
8,24 13,73 23,92 |
|
Agua para consumo humano |
Agua potable Cisterna Entubada Botellón |
0,15 |
16,47 10,20 5,88 13,33 |
|
Hábitos higiénicos |
Lavado de manos Lavado de frutas y verduras |
0,0062 |
27,84 18,04 |
|
Servicio de recolección de basura |
Si No |
0,020 |
12,55 33,33 |
Según los datos presentados en la tabla 4, el 23,92 % de la población conviven con sus mascotas en el interior del hogar y presentan parasitosis intestinal. Así mismo, el 10,59 % de la población de estudio cuenta con servicio de alcantarillado, el 14,12 % posee letrina, sin embargo, el 21,18 % de la población de estudio cuenta con pozo séptico. En cuanto a la infraestructura del hogar, el 23,92 % posee una vivienda de cemento armado, el 13,73 % casa de adobe y el 8,24 % vive una choza.
Por otro lado, el 5,88 % dispone de agua entubada y el 10,20 % posee agua almacenada en una cisterna donde por las condiciones, aumenta el crecimiento de bacterias y protozoos. Por último, el 27,84 % lavan sus manos después de ir al baño, y el 18,04 % lavan las frutas o verduras. Así también, el 33,33 % de los niños parasitados no poseen servicio de recolección de basura en sus comunidades.
Frecuencia de bacterias de la microbiota intestinal de niños escolares
De 117 muestras que correspondían a niños con parasitosis intestinal, el 2 % presentaba una infección severa por G. lamblia. La primera muestra codificada como NG251 como se muestra en la figura 1, se evidenció una elevada prevalencia de especies de la familia Prevotellaceae (54 %), como Prevotella sp., Prevotella copri, Massiliprevotella massiliensis, seguido de Firmicutes (27 %) que constituyen especies como Phascolarctobacterium succinatutents, Faecalibacterium prausnitzii, Blautia stercoris, Blautia faecis, Blautia stercors, Lactobacillus rogosae, Holdemanella biformis, Veillonella biformis, Clostridium septicum, Gemmiger formicilis, Ruminococcus champanellensis, Coprococcus comes, Coprococcus eutactus, Dorea longicatena, Roseburia faecis, Fusicatenibacter saccharivorans, Eubacterium coprostanoligenes, Gemmiger foricilis, Clostridium septicum. Así mismo, la familia Treponema (17 %) con especies representativas como Treponema berlinense, Treponema succinafaciens. Finalmente, las especies con menor frecuencia fueron Victivallis vadensis (0,3 %), Fusobacterium nucleatum (0,03 %).
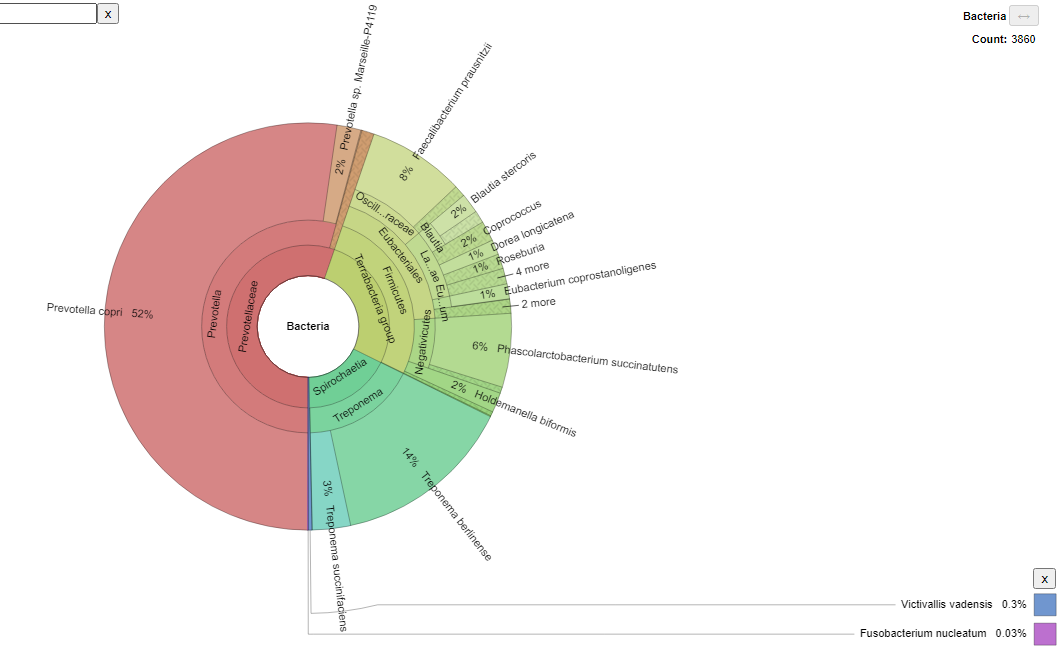
Figura 1. Microbiota bacteriana de NG251
En la segunda muestra NG253 señalada en la figura 2, un alto porcentaje (40 %) provienen de la región 16S amplificadas, mismas que corresponden a organismos que no fueron reconocidos en la base de datos de laboratorio BioSin Ciencias, debido a que no se han logrado cultivar dichas cepas. Así también el 0,4 % y el 0,2 %, se relacionaron con bacterias Ruminales no cultivadas y Archeon metagenómico no cultivado, respectivamente. Sin embargo, el grupo de Proteobacteria (47 %) fueron los microorganismos de mayor prevalencia, dentro de este grupo se encontraron las especies Sutterella sp. YIT 12072, Campylobacter lanienae, y Comamonas kerstersii. Las especies correspondientes al grupo de Bacteroidetes (9 %), fueron Odoribacter splanchnicus, Kaistella yonginensis, y Bacteriodes sp.; seguidamente del grupo de Terrabacteria (2 %) que constituye especies como, Bifidobacterium pseodocatenulatum, Faecalibacterium so. No cultivas, y Eubacteriales bacterium no cultivas. En menos prevalencia, se evidenció la especie Victivallis vadensis (1 %).
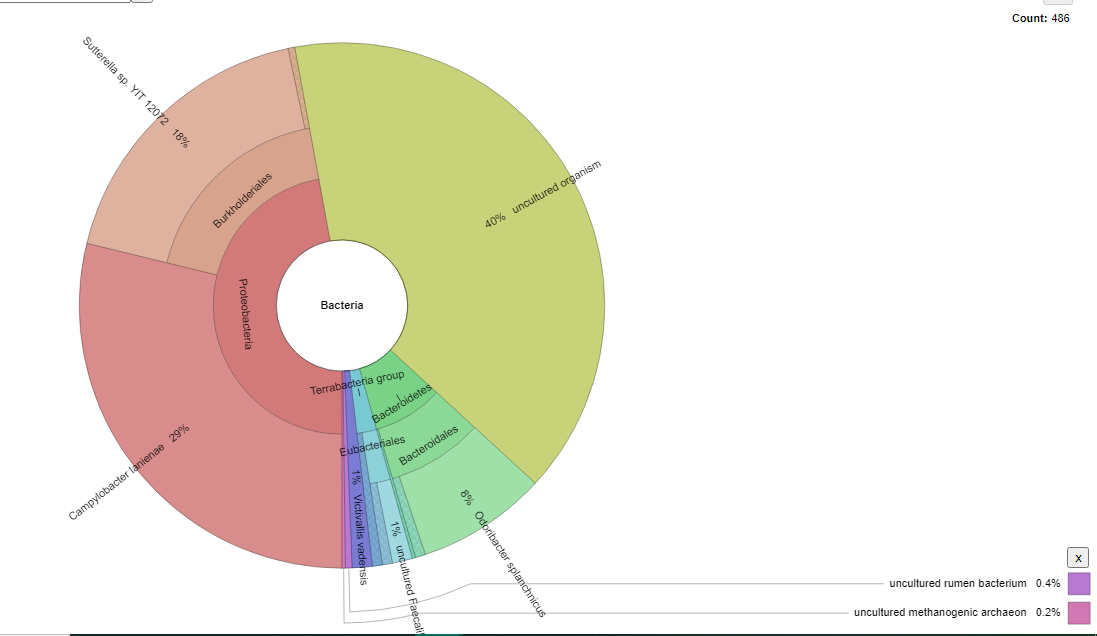
Figura 2. Microbiota bacteriana de NG253
DISCUSIÓN
La disbiosis intestinal y la infección parasitaria en menores de edad, son las patologías más frecuentes a nivel del tracto digestivo, siendo aún mayor en países en vías de desarrollo. Ecuador, existe información limitada en cuanto a la microbiota y parasitosis intestinal en niños pertenecientes a las zonas rurales de la provincia de Chimborazo, mismo que causa gran preocupación, debido a que es una de las causas de morbilidad ambulatoria del Ministerio de Salud Pública del Ecuador en el año 2014, y una las primeras causas de consulta pediátrica.(13)
En este estudio se detectó una prevalencia de parasitosis intestinal del 44,32 %, con mayor índice de frecuencia en niños varones; mismos resultados coincide con otras investigaciones recientes, el 44,8 % de parasitosis en niños escolares de la provincia de Manabí.(11) Por igual, cierto sector rural de Paute, presentó una prevalencia de 23,52 %, siendo significativa la infección parasitaria en varones.(4)
Con relación al tipo de infección parasitaria, existe una elevada frecuencia de niños escolares con monoparasitosis, y dentro los agentes parasitarios con mayor prevalencia en zonas rurales del Ecuador, se identificó un predominio de: Entamoeba coli, Entamoeba histolytica, y Giardia lamblia, siendo los dos últimos reportado por su alto nivel de patogenicidad y el desarrollo de enfermedades intestinales y sistémica,(14,15) dichos resultados reportados concuerdan con los encontrados en esta investigación.
En cuanto a los factores de riesgo en base al análisis estadístico, existe una relación directa entre la parasitosis intestinal y el contacto con animales en el hogar. Dicho resultado mantiene relación con otro estudio, las comunidades rurales están en contacto directo con animales domésticos, ganado y animales de granja, que implica ser un riesgo epidemiológico puesto que esparcen sus excrementos en entornos utilizados mayoritariamente por los niños.(16) Así también, las aguas residuales son desechadas en infraestructuras inadecuadas, habitualmente están no se poseen cubiertas o el agua residual se filtran bajo la tierra, como consecuencia, se desborda en cerca de las viviendas.
Además, la calidad de agua también influye en la parasitosis intestinal infantil, debido a que la cloración de las comunidades no se rige a las normas nacionales, que van desde los 0,3 y 1,5 ppm de cloro residual.(16) En el año 2017, se analizaron muestras de agua sin tratamiento adecuado, evidenciando más de 5 patógenos entéricos, mismos que pueden causar manifestaciones clínicas graves, como la diarrea crónica.(17)
Consecuentemente, varios estudios reportan resultados de la microbiota intestinal en niños menores de 5 años, es así que en estudios realizados en China y Estados Unidos, en niños de edades comprendidas de 3-36 meses de edad y de 1 a 4 años respectivamente, los filos Bacteroidetes, Firmicutes, Proteobacteria y Actinobacteria fueron los más dominantes en las edades señalas de los infantes.(18,19) Estos resultados difieren de los encontrados en esta investigación debido a que los niños participantes comprendían edades entre 5 y 10 años. Otro de las razones por la cual los resultados son diferentes, es debido a la zona geográfica donde viven, y a los factores como dieta, ambiente, exposición a fármacos, entre otros.(20,21)
No obstante, a partir de los 3 años de edad, la microbiota intestinal alcanza madurez y puede ser comparada con la de un adulto (19,22), siendo así, se plantea agrupar a los niños mayores de 4 años con individuos de 4 a 20 años de edad.(19,23) Sin embargo, los hallazgos de la presente investigación confirman la variabilidad de la microbiota intestinal en niños de diferentes edades.
Ciertas especies son propias del organismos humano y constituyen parte fundamental para el correcto funcionamiento de los sistemas, es así que las especies en niños sanos abundan especies del género Lactobacillus, Firmicutes, Proteobacterias, Bacteroidetes (incluye a los Bacteroides y Prevotella), y algunas especies del género Clostridium, mismos que mantienen una relación de simbiosis.(24) pero en ciertos casos, puede presentarse disbiosis, es decir aumento o disminución de dichas bacterias comensales. En nuestro caso, ambas muestras de heces sometidas a análisis molecular, provenían de niños con poliparasitosis. En la actualidad, no existen estudios donde se relacione la parasitosis con la disbiosis, ya que la modificación de los grupos microbianos se asocia a enfermedades como obesidad, síndrome de intestino irritable, enfermedad de Crohn, otros.(25)
Con respecto a las especies de mayor significancia clínica, como la de los géneros Roseburia y Eubacteria, son más prevalentes cuando el niño presenta dieta rica en fibra, tal es el caso de Prevotella que elevan su proporción en dietas que contienen verduras y vegetales. Faecalibacterium prausnitzii tienden a reducirse en la enfermedad de intestino irritable y la obesidad, lo perjudicial es que no se puede restablecer con tratamiento probiótico.(26)
La muestra NG253 no presentó algunas de estas especies en su microbiota, este análisis puede tener relación a que el individuo presenta alto consumo de grasas saturadas, a diferencia de NG251 presenta un buen estado de la microbiota intestinal debido a la diversidad de bacterias que contenía la muestra, mismas que señalan ser beneficiosas en el individuo.
Por este motivo, la nutrición en menores de edad es un factor importante para el correcto desarrollo de la microbiota, además es importante concientizar a las madres de familia, sobre la alimentación balanceada en su dieta diaria.
CONCLUSIONES
La prevalencia de parasitosis fue de 44,32 % en 264 niños de 5 a 10 años de edad, de esta población el 58,12 % presentó monoparasitosis y el 41,88 % parasitosis mixta. En cuanto a la especie parasitaria con mayor frecuencia fue Entamoeba coli con 58,86 %, Entamoeba histolytica en un 17,72 %, Giardia lamblia 10,13 %, y en un 3,16 % las especies Chilomastix mesnilii, Hymenolepis nana, y Iodamoeba bütschlii. Mediante el método de flotación de Willis se pudo encontrar huevos de Trichuris trichiura. Además, se correlacionó el contacto con mascotas, decadencia en la infraestructura de servicio higiénico, la falta de hábitos higiénicos y recolección de basura, como los principales factores de riesgo de la parasitosis intestinal en la población de estudio.
Esta es la primera investigación en niños de zonas rurales de la provincia de Chimborazo, Ecuador, que aborda el análisis de Biología Molecular mediante la técnica que conllevó a la determinación de la microbiota intestinal identificando grupos importantes del Dominio Bacteria: Prevotella 55 %, así también especies de los filos: Proteobacterias 47 %, Firmicutes en 27 %, y el género Treponema con 17 %. Mientras que en menor prevalencia: Bacteroidetes 9 %, Terrabacteria 2 %, Victivallis vadensis entre 0,3 a 1 %, y 0,03 % de Fusobacterium nucleatum. Lo que indica que la infección por parasitosis intestinal, con mayor prevalencia de Giardia lamblia afecta a la microbiota intestinal provocando disbiosis.
REFERENCIAS BIBLIOGRÁFIAS
1. Álvarez G, Sección C, Álvarez-Calatayud G, Guarner F, Requena T, Marcos A. Dieta y microbiota. Impacto en la salud. Nutrición Hospitalaria [Internet]. 2018 [cited 2023 Apr 24];35(6):11–5. Available from: http://creativecommons.org/licenses/by-nc-sa/4.0/
2. Barros-García P, Martínez-Escribano B, Romero -González J. Parasitosis intestinales. 2023 [cited 2023 Aug 16];1:123–37. Available from: www.aeped.es/protocolos/
3. Gómez-Gamboa L, Velasco V, Villasmil J, Ginestre M, Bermúdez-González J, Perozo-Mena A, et al. Parásitos intestinales y bacterias enteropatógenas en niños de edad escolar de Maracaibo, Venezuela. Kasmera [Internet]. 2018 [cited 2023 Apr 27];46(1):17–25. Available from: https://sites.google.com/prod/view/revistakasmera/vol%C3%BAmenes/2016-2020-vols-44-47/2018-v-46-n-1/17-25?authuser=0
4. Cuenca-León K, Sarmiento-Ordóñez J, Blandín-Lituma P, Benítez-Castrillón P, Pacheco-Quito EM. Prevalence of intestinal parasitosis in the child population of a rural area of Ecuador. Bol Malariol Salud Ambient. 2021 Dec 1;61(4):596–602.
5. Belkessa S, Ait-Salem E, Laatamna AE, Houali K, Sönksen UW, Hakem A, et al. Prevalence and Clinical Manifestations of Giardia intestinalis and Other Intestinal Parasites in Children and Adults in Algeria. Am J Trop Med Hyg [Internet]. 2021 Mar 1 [cited 2023 Apr 27];104(3):910–6. Available from: https://pubmed.ncbi.nlm.nih.gov/33534771/
6. Guillot CC. Microbiota intestinal y salud infantil. Rev Cubana Pediatr [Internet]. 2017 Dec 23 [cited 2023 Apr 26];90(1). Available from: https://revpediatria.sld.cu/index.php/ped/article/view/320/176
7. Grande A, Gayol P, Redondo J, González P. Infecciones gastrointestinales prevalentes en pediatría. BOL PEDIATR [Internet]. 1998 [cited 2023 Apr 26];38(166):220–41. Available from: https://www.sccalp.org/boletin/166/BolPediatr1998_38_220-241.pdf
8. Caguana-Espinoza L. ESCUELA SUPERIOR POLITÉCNICA DE CHIMBORAZO FACULTAD DE CIENCIAS “PREVALENCIA DE PARASITOSIS INTESTINAL Y SU CORRELACIÓN CON LOS ESTADOS ANÉMICOS QUE AFECTAN EL ESTADO NUTRICIONAL DE LA POBLACIÓN DE LA PARROQUIA DE LICTO” [Internet]. [Riobamba]: Escuela Superior Politécnica de Chimborazo; 2022 [cited 2024 Feb 19]. Available from: http://dspace.espoch.edu.ec/handle/123456789/17338
9. Restrepo Von Schiller CI, Mazo Berrío PL, Salazar Giraldo LM, Montoya Palacio NM, Botero Garcés HJ. Evaluación de tres técnicas coproparasitoscópicas para el diagnóstico de geohelmintos intestinales. 26(1):15–24.
10. Hernández M, Quijada NM, Rodríguez-Lázaro D, Eiros JM. Aplicación de la secuenciación masiva y la bioinformática al diagnóstico microbiológico clínico. Rev Argent Microbiol. 2020 Apr 1;52(2):150–61.
11. Castro-Jalca JE, Mera-Villamar L, Schettini Álava M. Epidemiología de las enteroparasitosis en escolares de Manabí, Ecuador. Kasmera [Internet]. 2020 Jun 1 [cited 2023 Apr 24];48(1). Available from: https://zenodo.org/record/3872171
12. Wasihun AG, Teferi M, Negash L, Marugán J, Yemane D, McGuigan KG, et al. Intestinal parasitosis, anaemia and risk factors among pre-school children in Tigray region, northern Ethiopia. BMC Infect Dis [Internet]. 2020 May 27 [cited 2024 Feb 18];20(1). Available from: /pmc/articles/PMC7251880/
13. Gómez-Barreno L, Abad-Sojos A, Inga-Salazar G, Simbaña-Pilataxi D, Flores-Enríquez J, Martínez-Cornejo I, et al. PRESENCE OF INTESTINAL PARASITOSIS IN A MARGINAL URBAN SCHOOL COMMUNITY OF ECUADOR. CIMEL [Internet]. 2017 [cited 2023 May 29];22(2):52–6. Available from: https://doi.org/10.23961/cimel.2017.222.953.
14. Durán-Pincay Y, Rivero-Rodríguez Z, Bracho-Mora A. Prevalencia de parasitosis intestinales en niños del Cantón Paján, Ecuador. Kasmera [Internet]. 2019 Sep 4 [cited 2023 Jun 3];47(1):44–9. Available from: https://www.redalyc.org/journal/3730/373061540008/html/
15. Jacobsen KH, Ribeiro PS, Quist BK, Rydbeck B V. Prevalence of Intestinal Parasites in Young Quichua Children in the Highlands of Rural Ecuador. J Health Popul Nutr [Internet]. 2007 Dec [cited 2023 Aug 8];25(4):399. Available from: /pmc/articles/PMC2754013/
16. González-Ramírez LC, Robalino-Flores X, De la Torre E, Parra-Mayorga P, Prato JG, Trelis M, et al. Influence of Environmental Pollution and Living Conditions on Parasite Transmission among Indigenous Ecuadorians. International Journal of Environmental Research and Public Health 2022, Vol 19, Page 6901 [Internet]. 2022 Jun 4 [cited 2023 Aug 9];19(11):6901. Available from: https://www.mdpi.com/1660-4601/19/11/6901/htm
17. Ribas A, Jollivet C, Morand S, Thongmalayvong B, Somphavong S, Siew CC, et al. Intestinal Parasitic Infections and Environmental Water Contamination in a Rural Village of Northern Lao PDR. Korean J Parasitol [Internet]. 2017 Oct 1 [cited 2023 Aug 11];55(5):523. Available from: /pmc/articles/PMC5678468/
18. Niu J, Xu L, Qian Y, Sun Z, Yu D, Huang J, et al. Evolution of the Gut Microbiome in Early Childhood: A Cross-Sectional Study of Chinese Children. Front Microbiol. 2020 Apr 3;11:475213.
19. Ringel-Kulka T, Cheng J, Ringel Y, Salojärvi J, Carroll I, Palva A, et al. Intestinal Microbiota in Healthy U.S. Young Children and Adults—A High Throughput Microarray Analysis. PLoS One [Internet]. 2013 May 23 [cited 2023 Aug 15];8(5):e64315. Available from: https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0064315
20. Heikkilä AR, Elovainio M, Raaska H, Matomäki J, Sinkkonen J, Lapinleimu H. Intestinal parasites may be associated with later behavioral problems in internationally adopted children. PLoS One [Internet]. 2021 Jan 1 [cited 2023 Apr 26];16(1):1–14. Available from: /pmc/articles/PMC7833226/
21. Weersma RK, Zhernakova A, Fu J. Interaction between drugs and the gut microbiome. Gut [Internet]. 2020 Aug 1 [cited 2023 Apr 26];69(8):1519. Available from: /pmc/articles/PMC7398478/
22. Castro-Jalca J, Mera-Villamar L, Schettini-Ávila M. Epidemiología de las enteroparasitosis en escolares de Manabí, Ecuador. KASMERA [Internet]. 2020 [cited 2024 Feb 18];48(1):1–8. Available from: https://zenodo.org/records/3872171
23. Ronan V, Yeasin R, Claud EC. Childhood Development and the Microbiome: The Intestinal Microbiota in Maintenance of Health and Development of Disease During Childhood Development HHS Public Access. Gastroenterology. 2021;160(2):495–506.
24. Saeed NK, Al-Beltagi M, Bediwy AS, El-Sawaf Y, Toema O. Gut microbiota in various childhood disorders: Implication and indications . World J Gastroenterol [Internet]. 2022 [cited 2023 Aug 16];28(18):1875–901. Available from: https://www.f6publishing.com
25. Sebastián Domingo JJ, Sánchez Sánchez C, Sebastián Domingo Servicio de Aparato Digestivo Hospital Royo Villanova Avda San Gregorio JJ. De la flora intestinal al microbioma. Revista Española de Enfermedades Digestivas [Internet]. 2018 [cited 2023 Aug 14];110(1):51–6. Available from: http://elpaissemanal.elpais.com/documentos/
26. Balerdi-Trébol M. La microbiota intestinal como órgano metabólico y sus interacciones con la dieta [Internet]. [Bilbao]: Universidad del País Vasco; 2019 [cited 2023 Aug 14]. Available from: https://addi.ehu.es/bitstream/handle/10810/43718/TFG_Balerdi_Trebol_Martin.pdf
AGRADECIMIENTOS
Un sincero agradecimiento a la Escuela Superior Politécnica de Chimborazo, por el apoyo en el desarrollo de apoyo. Al Gobierno Autónomo Descentralizado de San Luis por su participación y colaboración. Así mismo, a la Dra. Sandra Escobar y a la Dra. Verónica Cando, por el apoyo incondicional.
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo de la presente investigación.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses”.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Johana Lamiña, Breidy Lamiña
Curación de datos: Verónica Cando
Análisis formal: Sandra escobar
Investigación: Johana Lamiña, Andrea Donoso, Hugo Sánchez
Metodología: Yolanda Buenaño
Administración del proyecto: Sandra Escobar
Supervisión: Verónica Cando, Hugo Sánchez
Validación: Verónica Cando, Johana Lamiña, Breidy Lamiña
Visualización: Sandra Escobar.
Redacción – borrador original: Yolanda Buenaño.
Redacción – revisión y edición: Verónica Cando, Andrea Donoso.