Categoría: Health Sciences and Medicine
ORIGINAL
Caracterización epidemiológica y genética poblacional de la fucosidosis en la provincia Holguín, Cuba
Epidemiological and population genetic characterization of fucosidosis in Holguin province, Cuba
Víctor Jesús Tamayo Chang1
![]() *,
Estela Morales Peralta2
*,
Estela Morales Peralta2 ![]() *,
Elayne Esther Santana Hernández1
*,
Elayne Esther Santana Hernández1
![]() *, Paulina
Araceli Lantigua Cruz2
*, Paulina
Araceli Lantigua Cruz2 ![]() *,
Teresa Collazo Mesa2
*,
Teresa Collazo Mesa2 ![]() *,
Roberto Lardoeyt Ferrer3
*,
Roberto Lardoeyt Ferrer3 ![]() *
*
1Centro Provincial de Genética Médica, Hospital Pediátrico Universitario Provincial. Holguín, Cuba.
2Centro Nacional de Genética Médica. La Habana, Cuba.
3Instituto Superior Politécnico “Alvorecer da juventude”. Luanda, República Popular de Angola.
Citar como: Tamayo Chang VJ, Morales Peralta E, Santana Hernández EE, Lantigua Cruz PA, Collazo Mesa T, Lardoeyt Ferrer R. Epidemiological and population genetic characterization of fucosidosis in Holguin province, Cuba. Salud, Ciencia y Tecnología - Serie de Conferencias. 2024; 3:978. https://doi.org/10.56294/sctconf2024978
Recibido: 12-01-2024 Revisado: 01-05-2024 Aceptado: 15-07-2024 Publicado: 16-07-2024
Editor: Dr.
William Castillo-González ![]()
ABSTRACT
Introduction: fucosidosis is a rare lysosomal storage disease, of which in Cuba, patients have been reported only in Holguín province.
Objective: to characterize the epidemiological and genetic-population behavior of fucosidosis in Holguín province.
Method: a case series study was carried out, whose universe and sample included all families with patients with fucosidosis, diagnosed between 1985 and 2023. Birth prevalence, mortality rate, attributable mortality, and consanguinity rate were calculated. Gene and genotypic frequencies were estimated from the prevalence. A Hardy-Weinberg test for the analysis of gene equilibrium at the FUCA 1 locus was applied to the results of the genotypic characterization for the Q427X mutation.
Results: 19 patients were diagnosed, belonging to 13 families, which represented a birth prevalence of 3,28 x 105 live births. The case fatality and parental consanguinity rates were 0,84 and 0,53 respectively. The estimated frequencies of the recessive allele and the heterozygous genotype were 0,0057271 and 0,0113887, respectively, so approximately 11,660 people in the population of the Holguín province at the end of 2023 must have been carriers. The existence of gene equilibrium for the FUCA1 locus in the population genotypically characterized for the Q427X mutation suggests that the affected families have remained in the original region, and systematic and stochastic factors that alter gene frequencies, including the existence of gene flow, have not occurred since the apparition of the disease due to a founder effect. The mutation rate of the gene must have remained constant according to the selection coefficient at the locus, corresponding to a lethal disease whose fitness is zero.
Conclusions: the prevalence of fucosidosis in Holguín province is one of the highest worldwide and is the result of the combination of the founder effect due to genetic drift of the Q427X mutation, with parental consanguinity and genetic isolation due to socioeconomic causes.
Keywords: Fucosidosis; Q427X Mutation; Gene Frequency; Gene Equilibrium; Heterozygote; Founder Effect; Consanguinity; Gene Flow.
RESUMEN
Introducción: la fucosidosis es una enfermedad de almacenamiento lisosomal rara, de la que en Cuba solo se
han reportado enfermos en la provincia Holguín.
Objetivo: caracterizar el comportamiento epidemiológico y genético-poblacional en la provincia holguinera.
Método: se realizó un estudio de serie de casos, cuyo universo y muestra incluyó la totalidad de familias con enfermos de fucosidosis, diagnosticados entre 1985 y 2023. Se calcularon la prevalencia al nacimiento, la tasa de mortalidad, la mortalidad atribuible y la tasa de consanguinidad. Se estimaron las frecuencias génicas y genotípicas a partir de la prevalencia. A los resultados de la caracterización genotípica para la mutación Q427X se aplicó un test de Hardy-Weinberg para el análisis de equilibrio génico en el locus FUCA 1.
Resultados: se diagnosticaron 19 enfermos, pertenecientes a 13 familias, lo cual representó una prevalencia al nacimiento de 3,28 x 105 nacidos vivos. Las tasas de letalidad y consanguinidad parental fueron de 0,84 y 0,53 respectivamente. Las frecuencias estimadas del alelo recesivo y del genotipo heterocigoto fueron 0,0057271 y 0,0113887, respectivamente, por lo que aproximadamente 11 660 personas de la población de la provincia holguinera al finalizar el año 2023 debieron ser portadoras. La existencia de equilibrio génico para el locus FUCA 1 en la población caracterizada genotípicamente para la mutación Q427X, sugiere que las familias afectadas se han mantenido en la región originaria, y no debieron influir factores sistemáticos y estocásticos que alteraran las frecuencias génicas, entre ellos la existencia de flujo génico, desde que por un efecto fundador se gestara la enfermedad. La tasa de mutación del gen debe haberse mantenido constante de acuerdo al coeficiente de selección en el locus, al corresponderse con una enfermedad letal cuyo fitness es de cero.
Conclusiones: la prevalencia de la fucosidosis en la provincia Holguín es una de las más altas a nivel mundial y es el resultado de la combinación del efecto fundador por deriva génica de la mutación Q427X, con la consanguinidad parental y el aislamiento genético por causas socioeconómicas.
Palabras clave: Fucosidosis; Mutación Q427X; Frecuencia de los Genes; Equilibrio Génico; Heterocigoto; Efecto Fundador; Consanguinidad; Flujo Génico.
INTRODUCCIÓN
La promesa de dignidad igualitaria para todos los seres humanos ha sido un objetivo latente de la Organización de las Naciones Unidas, y su Convención sobre los derechos del niño, ha ejercido un papel especialmente importante en la vida de poblaciones infantiles vulnerables, entre ellas aquellas que viven con enfermedades raras.(1)
Los criterios utilizados para definir las enfermedades raras han incluido descriptores cualitativos como la gravedad, la mortalidad, la causa hereditaria, o la disponibilidad de tratamientos alternativos; sin embargo, los descriptores cuantitativos, como la prevalencia, que pueden ser medidos epidemiológicamente, han sido los más utilizados explícita o implícitamente en la mayoría de las definiciones.(2)
Se dice que una enfermedad es rara cuando su prevalencia es baja en comparación con las enfermedades comunes, no obstante determinar un umbral de prevalencia es un desafío, por la variedad de las fuentes de información que lo originan o por la falta de determinados criterios diagnósticos. Eso ha conllevado a que no exista una definición única, unificada y universalmente aceptada y, en consecuencia, algunas enfermedades pueden considerarse raras en un país, pero no en otro, debido a la diversidad genética de las poblaciones, a factores ambientales o sociales, o a problemas de supervivencia en las diferentes regiones.(2)
La fucosidosis es una enfermedad de almacenamiento lisosomal (EAL), considerada como ultra rara en la mayoría de los países, ya que solo se han reportado aproximadamente 130 enfermos en todo el mundo.(3) Su causa es la actividad deficiente o ausente de la enzima lisosomal ɑ-L-fucosidasa-1, debida a mutaciones en la estructura del gen FUCA1 localizado en el locus 1p36.11, lo cual conlleva a la acumulación de glicoproteínas y glicolípidos fucosilados en varios tejidos y órganos.(4)
La variedad de hallazgos clínicos que incluye esta enfermedad autosómico recesiva, es muy amplia, y predomina un deterioro neurológico que inexorablemente lleva a la muerte antes de los 10 años de edad en menos de la mitad de los enfermos, y después de los 20 años solo en un 40 % de ellos.(5)
La correlación genotipo-fenotipo no está bien definida debido a que la mayoría de los afectados son homocigotos para diferentes mutaciones y sólo unas pocas mutaciones se repiten en pacientes no emparentados. Sin embargo, la mutación sin sentido Q427X, que es producida por un cambio de citosina por timina en la posición 1279 en el exón ocho del gen, y que conlleva a que un codón de glutamina (Q) en la posición 427 sea sustituido por un codón de parada de la síntesis de aminoácidos, se ha encontrado en enfermos con distintos orígenes étnicos.(5,6)
El tratamiento actual en la gran mayoría de los casos, se limita al manejo de las complicaciones y al apoyo con fisioterapia. Sin embargo, los modelos animales generados han esclarecido la neuropatología de la enfermedad, y han abierto el camino para posibles terapias. El trasplante de células madres hematopoyéticas se ha aplicado a un pequeño número de pacientes, con estabilización de los síntomas en algunos; a su vez, la terapia de reemplazo enzimático se ha probado en estudios preclínicos, pero aún no se cuenta con ensayos clínicos de terapia génica.(6)
A pesar de que la prevalencia de fucosidosis globalmente se ha estimado en 1 por cada 200000 nacidos vivos (NV), se han reportado cifras inusuales de enfermos en regiones del sur de Italia, en poblaciones de origen indo-mexicano de Arizona y Colorado en los Estados Unidos de Norteamérica, en Túnez, y en Cuba; donde todos los afectados han procedido de la provincia Holguín, y poseen la mutación Q427X como causa de la enfermedad.(3,5,6,7,8) Eso motivó la presente investigación que tuvo como objetivo caracterizar el comportamiento epidemiológico y genético-poblacional de la fucosidosis en la provincia holguinera.
MÉTODO
Se realizó un estudio descriptivo, tipo serie de casos, cuyo universo y muestra incluyó la totalidad de familias con enfermos de fucosidosis, diagnosticados desde la instauración de los servicios de Genética Médica en la provincia Holguín, en el año 1985 hasta finales del 2023.
Los datos demográficos (fechas de nacimiento y fallecimiento, sexo y color de la piel); así como los resultados de los estudios moleculares de los pacientes y sus familiares se tomaron de las historias clínicas.
Mediante el software Geno Pro 2016, fueron construidas las genealogías correspondientes a las familias afectadas, donde se incluyeron al menos cinco generaciones. Las familias fueron identificadas con letras mayúsculas y su ordenamiento dependió del momento de diagnóstico del primer afectado en ellas. Se investigaron el lugar de procedencia de los enfermos y sus ancestros según municipios y localidades, y el antecedente de consanguinidad parental.
Se calculó la prevalencia al nacimiento por el método publicado por Poorthuis en 1999. La misma se obtuvo de la división del número total de enfermos diagnosticados entre el número total de NV en el período comprendido entre el año de nacimiento del paciente de mayor edad y el año de nacimiento del paciente de menor edad.(9) Ese indicador se expresó como el número de pacientes por cada 105 NV.
Como en todas las enfermedades con patrón de herencia autosómico recesivo, la prevalencia estimada al nacimiento se correspondió con la frecuencia estimada del genotipo homocigoto recesivo causante de la enfermedad. Al existir en la población holguinera una única mutación causal (Q427X), la raíz cuadrada de la prevalencia estimada al nacimiento o frecuencia estimada del genotipo homocigoto recesivo posibilitó calcular la frecuencia génica estimada relativa del alelo recesivo, bajo la asunción del precepto de la ley de Hardy-Weinberg del equilibrio genético de las poblaciones suficientemente grandes y con matrimonios al azar. En base a ello, se calcularon la frecuencia génica estimada relativa del alelo dominante y la frecuencia estimada del genotipo heterocigótico o frecuencia de portadores, según las fórmulas:
· Frecuencia génica estimada relativa del alelo dominante = 1- Frecuencia génica estimada relativa del alelo recesivo, y
· Frecuencia estimada del genotipo heterocigótico = 2 x Frecuencia génica estimada relativa del alelo dominante x Frecuencia génica estimada relativa del alelo recesivo.(10)
El número estimado de portadores de la mutación Q427X se obtuvo a partir de la frecuencia estimada del genotipo heterocigótico, y en relación al total de la población de la provincia Holguín al finalizar el año 2022.
Se calculó la tasa de letalidad por fucosidosis mediante la división del número total de fallecidos por la enfermedad entre el total de enfermos diagnosticados al concluir el estudio, y se expresó en proporciones. La mortalidad atribuible a la enfermedad se obtuvo del cociente del número total de fallecidos por causa de la enfermedad al concluir el estudio entre el número total de NV en el período comprendido entre el año de nacimiento del paciente de mayor edad y el año de nacimiento del paciente de menor edad, y se expresó como el número de fallecidos por cada 105 NV.
La frecuencia de consanguinidad de la enfermedad se calculó como el cociente del número total de enfermos de fucosidosis con antecedentes de padres consanguíneos y el total de enfermos diagnosticados al concluir el estudio.
El número total de NV por años se obtuvo del anuario estadístico de la dirección provincial de Salud Pública de Holguín, y los datos poblacionales utilizados se tomaron de los informes de la Oficina Nacional de Estadística e Información (ONEI) de la República de Cuba.(11)
Para el análisis de la existencia de equilibrio génico en el locus FUCA1 se aplicó un test de Hardy-Weinberg a los resultados de la caracterización genotípica para la mutación Q427X de una serie de 64 casos, seleccionada mediante muestreo no probabilístico opinático, en la que se incluyeron a todos los enfermos diagnosticados enzimáticamente, y a familiares con riesgo a priori de ser portadores. Con los datos de las frecuencias genotípicas observadas se calcularon las frecuencias génicas del alelo recesivo y del alelo dominante, y las frecuencias esperadas de los genotipos homocigótico recesivo, homocigótico dominante y heterocigótico mediante las fórmulas:(10)
· Frecuencia génica del alelo recesivo (q) = Frecuencia observada del genotipo homocigótico recesivo + 1/2 x Frecuencia observada del genotipo heterocigótico
· Frecuencia génica del alelo dominante (p) = Frecuencia observada del genotipo homocigótico dominante +1/2 x Frecuencia observada del genotipo heterocigótico
· Frecuencia esperada del genotipo homocigótico recesivo = (Frecuencia génica del alelo recesivo)(2)
· Frecuencia esperada del genotipo homocigótico dominante = (Frecuencia génica del alelo dominante)(2)
· Frecuencia esperada del genotipo heterocigótico = 2 x Frecuencia génica del alelo dominante x Frecuencia génica del alelo recesivo
Se consideró significación estadística para valores de p ≤ 0,05.
Para facilitar el manejo de la información se creó una base de datos primarios en el microprocesador Excel. El procesamiento de los datos se realizó con el empleo del paquete estadístico “SPSS for Windows”. Para la descripción de las variables se utilizaron los estadígrafos: frecuencia absoluta, por ciento y proporciones. A cada uno de los indicadores y parámetros se les calculó el intervalo de confianza al 95 %.
La investigación se llevó a cabo en correspondencia con las regulaciones establecidas en las declaraciones de Helsinki (2013) y Edimburgo (2000) para las investigaciones médicas con seres humanos.(12)
RESULTADOS
En la provincia Holguín se han diagnosticado 19 enfermos de fucosidosis, pertenecientes a 13 familias aparentemente no relacionadas. En dos familias se agrupaban seis y dos enfermos, respectivamente (ver árboles genealógicos en las figuras 1 y 2). Los 11 afectados restantes eran casos únicos en sus familias.
El 57,9 % de los enfermos (11) pertenecía al sexo femenino y los ocho restantes al sexo masculino. La piel del 94,7 % de los enfermos (18) fue percibida como de color blanca, y solo el restante afectado fue catalogado como mestizo. El 91,4 % de los 35 progenitores de enfermos (32) fue clasificado como de piel de color blanca y los tres restantes como mestizos. Al concluir el estudio 16 enfermos habían fallecido como consecuencia de la enfermedad, y solo tres se encontraban vivos.
El grupo de 19 enfermos tenía un total de 16 hermanos nacidos vivos, 10 varones y seis hembras. De ellos, una pareja de hermanos de distinto sexo están incluidos en la totalidad de enfermos descritos en la presente investigación, pero tres de los restantes hermanos (dos hembras y un varón) habían fallecido con características clínicas sugerentes de fucosidosis previo al diagnóstico de la enfermedad en sus familias.
En el periodo comprendido entre los años de nacimiento de los pacientes de mayor y menor edad (1976 y 2015), en la provincia Holguín nacieron vivos 579 985 niños, por lo que la prevalencia al nacimiento de la fucosidosis fue de 3,28 x 105 NV (1 x 30488 NV) (tabla 1).
|
Tabla 1. Algunos indicadores epidemiológicos de la fucosidosis en la provincia Holguín |
||||
|
Indicadores |
Casos con estudio enzimático y molecular (N=19) |
Total de casos al asumir presuntivos (N=22) |
||
|
EP |
IC95 % |
EP |
IC95 % |
|
|
Prevalencia al Nacimiento |
3,28* |
3,28 - 3,28 |
3,79* |
3,79 - 3,79 |
|
Tasa de Letalidad |
0,84 |
0,82 - 0,86 |
0,86 |
0,85 - 0,87 |
|
Muertes atribuibles |
2,76* |
2,76 -2,76 |
3,28* |
3,28 - 3,28 |
|
Frecuencia de consanguinidad |
0,53 |
0,49 – 0,56 |
0,50 |
0,47 - 0,53 |
|
Leyenda: EP: Estimación puntual; IC95 %: Intervalo de confianza del 95 %, * x105 Nacidos Vivos |
||||
La tasa de letalidad de la enfermedad fue de 0,84 con un intervalo de confianza del 95 % entre 0,82 - 0,86 y le fue atribuible un fallecimiento por cada 36232 NV. Si se adicionaran los tres hermanos de enfermos que fallecieron con síntomas y signos clínicos sugerentes de la enfermedad; pero que no se les realizaron los estudios confirmativos, la prevalencia al nacimiento de la enfermedad ascendería a 3,79 x 105 NV (1 por cada 26385 NV) y la tasa de letalidad a 0,86.
La tasa de consanguinidad parental fue de 0,53 con un intervalo de confianza del 95 % entre 0,49 – 0,56. Los 10 descendientes de matrimonios emparentados se incluían en seis de las familias identificadas. En cuatro de los seis afectados de la familia C se pudo demostrar la existencia de lazos sanguíneos parentales (enfermos: VIII-2, VIII- 5, VIII-6 y IX-1, en el árbol genealógico 1- figura 1). Los enfermos VIII-5 y VIII-6 eran medio hermanos, y la repetición de la enfermedad en ellos fue debido a la consanguinidad de las dos uniones matrimoniales maternas. En la familia L se evidenció consanguinidad múltiple, y los dos enfermos incluidos en ella (enfermos VII-1 y VII-2 en el árbol genealógico 2- figura 2) procedían de padres con ancestros comunes. En cuatro de las restantes 11 familias, donde los casos eran únicos, también se constató consanguinidad parental.
En la tabla 2 se muestran algunos parámetros de genética poblacional estimados a partir de la prevalencia de la fucosidosis en la provincia Holguín. La frecuencia génica estimada del alelo recesivo fue 0,0057271 y la del alelo dominante 0,9942729. Eso conllevó a que la frecuencia estimada del genotipo heterocigoto fuera de 0,0113887, y por tanto se pudiera asumir que aproximadamente más de 11000 personas de la población holguinera al finalizar el año 2022 debieron ser portadoras de fucosidosis.
Si se tuvieran en consideración los tres hermanos de enfermos con sospecha clínica de fucosidosis, la frecuencia génica estimada del alelo recesivo ascendería a 0,0061563, y la frecuencia estimada de heterocigotos a 0,0122368, y por tanto se pudiera asumir que aproximadamente más de 12000 habitantes de Holguín al finalizar el año 2022 debieron ser portadores de la enfermedad.
Los resultados del estudio genotípico realizado, e incluidos en las historias clínicas, mostraron que los 19 enfermos de fucosidosis presentaban la mutación Q427X en doble dosis, de la que 38 de los familiares con riesgo a priori eran portadores, y siete no la portaban.
|
Tabla 2. Algunos parámetros de genética poblacional estimados a partir de la prevalencia de la fucosidosis en la población de la provincia Holguín |
||||
|
Indicadores |
Casos con estudio enzimático y molecular (N=19) |
Total de casos al asumir presuntivos (N=22) |
||
|
EP |
IC95 % |
EP |
IC95 % |
|
|
Frecuencia del genotipo homocigótico recesivo |
0,0000328 |
0,0000327 - 0,0000329 |
0,0000379 |
0,0000379 - 0,0000379 |
|
Frecuencia del Genotipo homocigótico dominante |
0,9885785 |
0,9885785 - 0,9885786 |
0,9877253 |
0,9877252 - 0,9877253 |
|
Frecuencia del Genotipo heterocigótico |
0,0113887 |
0,0113883 - 0,0113890 |
0,0122368 |
0,0122364 - 0,0122372 |
|
Cifra estimada de portadores en la población* Frecuencia Génica del alelo recesivo
Frecuencia Génica del alelo dominante |
11 660
0,0057271
0,9942729 |
5885 - 17435
0,0057268 - 0,0057354 0,9942729 - 0,9942729 |
12 528
0,0061563 0,9938437 |
6601 - 18455
0,0061560 - 0,0061566 0,9938434 - 0,9938440 |
|
Leyenda: EP: Estimación puntual; IC95 %: Intervalo de confianza del 95 % *Población de la provincia Holguín al finalizar 2022: 1023783 habitantes |
||||
El análisis del test de Hardy Weinberg según los resultados de la caracterización genotípica para la mutación Q427X, no mostró diferencias estadísticamente significativas entre las frecuencias génicas y genotípicas observadas con las frecuencias esperadas (Tabla 3), por lo que se asumió la existencia de equilibrio génico para el locus FUCA1 en la población estudiada.
|
Tabla 3. Análisis del equilibrio génico de Hardy Weinberg para el locus FUCA1 según los resultados de la caracterización genotípica en relación con la mutación Q427X |
||||||
|
Genotipo |
Frecuencia relativa observada |
Frecuencia relativa esperada |
Valor del estimador X2 |
P valor |
||
|
EP |
IC95 % |
EP |
IC95 % |
|
|
|
|
Homocigótico recesivo |
0,297 |
0,285 - 0,309 |
0,352 |
0,341 - 0,364 |
0,053 |
0,97 |
|
Heterocigótico |
0,594 |
0,585 - 0,603 |
0,482 |
0,471- 0,493 |
||
|
Homocigótico dominante |
0,109 |
0,100 - 0,118 |
0,165 |
0,155 - 0,175 |
||
|
Frecuencia génica q=0,5937500 Frecuencia génica p=0,4062500 |
||||||
|
Leyenda: EP: Estimación puntual, IC95 %: Intervalo de confianza del 95 %, p: valor de la probabilidad para el test de Hardy Weinberg, q= Frecuencia génica del alelo recesivo, p: Frecuencia génica del alelo dominante |
||||||
En la figura 3 se muestra la distribución geográfica de los enfermos con fucosidosis según lugar de procedencia de las familias. Las familias de 12 enfermos se ubicaron en el noreste del municipio Holguín, y seis en localidades rurales de tres municipios colindantes con este. Solo la familia de una paciente se localizó separada de los actuales límites del municipio cabecera provincial.
DISCUSIÓN
Antes de 1991 existían dos regiones en las que se habían reportado los mayores números de enfermos de fucosidosis en el mundo; en el sur de Italia se habían diagnosticado 20 afectados, y ocho en la población indoamericana de Nuevo México y Colorado en los Estados Unidos.(5) Posteriormente, se reportaron 13 enfermos que habían nacido entre 1987 y 2010, y que procedían de diferentes regiones de Túnez.(7,13) Sin embargo, en la literatura consultada no se encontraron reportes de la prevalencia al nacimiento de la enfermedad en esas regiones, y a su vez son pocos los estudios de otros países, así como los relacionados con la prevalencia al nacimiento de las EAL en general.
Se ha reportado una prevalencia al nacimiento mundial de las EAL de 13,25 por 100000 NV.(14) En los Países Bajos la prevalencia total de las EAL diagnosticadas entre 1970 y 1996 fue de 14 por 100000 NV. La enfermedad de Pompe fue la más prevalente, y solo se diagnosticaron cinco enfermos de fucosidosis, lo cual reflejaba una prevalencia de 0,05 por cada 100000 NV.(9)
Un estudio de 2002 en Portugal identificó 29 diferentes EAL que aportaban en su conjunto una prevalencia de 25 por cada 100000 NV. Las entidades más frecuentes fueron la GM2 gangliosidosis (variante B), la mucolipidosis II/III, la enfermedad de Niemman-Pick tipo C y la leucodistrofia metacromática, pero no se diagnosticaron enfermos de fucosidosis.(15)
En la republica Checa la prevalencia al nacimiento de las EAL en el periodo entre los años 1975 y 2008 fue de 12,25 por cada 100000 NV, similar a la de Holanda, pero inferior a la de Portugal. La enfermedad de Gaucher fue la entidad más frecuente, y no se diagnosticaron pacientes con fucosidosis.(16)
En los Emiratos Árabes Unidos la prevalencia al nacimiento de la fucosidosis (2,02 por 100000 NV) fue cuatro veces mayor que en los países occidentales, pero fue muy inferior a la encontrada en el presente estudio, al solo haberse diagnosticado dos casos.(17)
En 2021 un estudio en Australia recolectó datos del período entre los años 2009 y 2020, en el que se confirmaron 734 diagnósticos postnatales de EAL. La prevalencia al nacimiento conjunta de los 38 trastornos individuales encontrados fue de 19,87 por cada 100000 NV. La enfermedad de Fabry fue la entidad más frecuente, sin embargo, se detectó un solo niño con fucosidosis, lo que representaba una prevalencia de 0,03 por cada 100000 NV.(18)
En un centro para el diagnóstico de alteraciones metabólicas hereditarias en Brasil, en el periodo 1982-2015 se confirmaron 3099 pacientes con EAL, lo que representaba el 71,6 % de los diagnósticos realizados, y por tanto la categoría más frecuente. Las entidades más prevalentes fueron; la enfermedad de Gaucher y las mucopolisacaridosis II, VI y I. Solo se identificaron cuatro pacientes con fucosidosis, para una prevalencia de 0,02 por 100000 NV.(19)
En Colombia se realizó un seguimiento de 22 años del tamizaje de alto riesgo de EAL. Ese estudio incluyó un total de 32940 niños, y mostró que las EAL más frecuentes eran la enfermedad de Gaucher, la mucopolisacaridosis IVA y la enfermedad de Fabry. Solo se diagnosticaron dos enfermos de fucosidosis en el periodo comprendido entre 1995 y 2016.(20)
En Cuba, por su parte, no se han encontrado enfermos de fucosidosis en otras regiones fuera de la provincia Holguín. Sin embargo, Willems y colaboradores reportaron cuatro enfermos de origen cubano que fueron diagnosticados y fallecieron en los Estados Unidos de Norteamérica. Los ancestros de las dos familias no emparentadas a las que pertenecían esos enfermos provenían de distintas localidades de la provincia Holguín.(5) En ambas familias se encontró la mutación Q427X como causa de la enfermedad, ello permitió hipotetizar que en todas las familias diagnosticadas en Cuba se debía encontrar la misma mutación, y establecer un protocolo para el diagnóstico molecular de la enfermedad.
La existencia de equilibrio génico para el locus FUCA 1 en la población caracterizada genotípicamente para la mutación Q427X en la presente investigación, sugiere la no existencia de factores sistemáticos y estocásticos que pudieran haber alterado las frecuencias génicas.(10) De ello se infiere que las familias afectadas se han mantenido en la región originaria, y no debió haber ocurrido flujo génico, desde que por un efecto fundador se gestó la enfermedad en Holguín.
A su vez, la tasa de mutación del gen debe haberse mantenido constante de acuerdo al coeficiente de selección en el locus en cuestión, al corresponderse con una enfermedad letal cuyo fitness es de cero. La frecuencia de la mutación Q427X reportada a nivel mundial es de 0,00002.(21) La frecuencia génica estimada en la población holguinera fue más de 200 veces superior a esa frecuencia reportada internacionalmente.
La existencia de una sola mutación causante de fucosidosis en los enfermos holguineros es sugerente que para el mantenimiento de la enfermedad aparte del aporte de la consanguinidad y de un posible efecto fundador, la frecuencia de portadores debe ser alta. El mantenimiento de una enfermedad autosómico recesiva esta mediada por una frecuencia relativamente alta del genotipo heterocigoto, que por la poca o ausente sintomatología que exhibe se diluye en la población fenotípicamente sana en general.(10)
La procedencia ancestral española de todas las familias con enfermos de fucosidosis en Holguín es sugerente de un efecto fundador por deriva génica de la mutación Q422X, cuya frecuencia es baja en otras regiones, incluido su posible país de origen. Hasta el año 2006 no se habían reportado enfermos en España, y los casos diagnosticados posteriormente procedían de familias de origen marroquí y griego.(22,23,24)
En varias regiones del mundo han existido grupos poblacionales de pequeño tamaño en los que determinadas enfermedades autosómico recesivas infrecuentes se han presentado con frecuencias relativamente altas debido al aislamiento genético.(25) En las subpoblaciones derivadas originalmente de un pequeño grupo de individuos, que han quedado aisladas debido a un evento fundacional, y se han mantenido como sociedades cerradas durante varias generaciones debido a barreras geográficas, socioeconómicas, religiosas, raciales, o lingüísticas, la deriva genética favorece algunas variantes genéticas y elimina otras, y las posibilidades de emparejamientos entre portadores de un trastorno recesivo concreto pueden ser elevadas.(25,26,27)
Las altas frecuencias de fucosidosis en la región de Calabria en Italia, y en la población de nuevo México y colorado en los Estados unidos fueron asociadas con el aislamiento genético.(5,25,28) La región donde se asentaron las familias de enfermos de fucosidosis cubanos se corresponde con la antigua jurisdicción de Holguín en los tiempos de la colonia española. Esa demarcación nació con la llegada de un grupo de familias españolas que se establecieron en la región que hoy ocupa la ciudad del mismo nombre y zonas aledañas, cuyo modo de producción agrícola de autoconsumo no requería de gran cantidad de esclavos, por lo que se mantuvo como un grupo cerrado que crecía desde adentro, y la endogamia se convirtió en una práctica frecuente.(8,29)
En análisis de los libros bautismales del archivo parroquial San Isidoro de Holguín se encontró que, desde antes de 1752, año en que se le confiere el título de ciudad y se crea la jurisdicción de dicho nombre, las familias originarias comenzaron a mezclarse entre si, y ocurrió un lento proceso de autocrecimiento de la comunidad. A su vez, la existencia de poco movimiento migratorio externo e interno, hizo que al llegar nuevos grupos humanos a la región durante el siglo XIX no ocurrieron modificaciones en el sustrato genético endogámico, consolidado ya por el tiempo.(8,29)
Una exploración de la estructura e historia demográfica de la población de Cuba, mediante el uso de un conjunto de datos de todo el genoma encontró una ascendencia común reciente más alta en Holguín que en el resto del país.(30)
Los resultados del presente estudio reflejan que la prevalencia de la fucosidosis en la provincia Holguín es una de las más altas a nivel mundial, y es el resultado de la combinación del efecto fundador por deriva génica de la mutación Q427X, con la consanguinidad parental y el aislamiento genético por causas socioeconómicas.
REFERENCIAS
1. Matthews L, Chin V, Taliangis M, Samanek A, Baynam G. Childhood rare diseases and the UN convention on the rights of the child. Orphanet J Rare Dis [Internet]. 24 de diciembre de 2021 [citado 3 de junio de 2024];16(1):523. Disponible en: https://doi.org/10.1186/s13023-021-02153-0
2. Abozaid GM, Kerr K, McKnight A, Al-Omar HA. Criteria to define rare diseases and orphan drugs: a systematic review protocol. BMJ Open [Internet]. 29 de julio de 2022 [citado 3 de junio de 2024];12(7): e062126. Disponible en: https://doi.org/10.1136/bmjopen-2022-062126
3. do Rosario MC, Purushothama G, Narayanan DL, Siddiqui S, Girisha KM, Shukla A. Extended analysis of exome sequencing data reveals a novel homozygous deletion of exons 3 and 4 in FUCA1 gene causing fucosidosis in an Indian family. Clin Dysmorphol [Internet]. 1 de julio de 2023 [citado 3 de junio de 2024];32(3):112-5. Disponible en: https://doi.org/10.1097/MCD.0000000000000452
4. Mao SJ, Zhao J, Shen Z, Zou CC. An unusual presentation of fucosidosis in a Chinese boy: a case report and literature review (childhood fucosidosis). BMC Pediatr [Internet]. 11 de julio de 2022 [citado 3 de junio de 2024];22(1):403. Disponible en: https://doi.org/10.1186/s12887-022-03414-y
5. Willems PJ, Gatti R, Darby JK, Romeo G, Durand P, Dumon JE, et al. Fucosidosis revisited: a review of 77 patients. Am J Med Genet [Internet]. enero de 1991 [citado 3 de junio de 2024];38(1):111-31. Disponible en: https://doi.org/10.1002/ajmg.1320380125
6. Stepien KM, Ciara E, Jezela-Stanek A. Fucosidosis-Clinical Manifestation, Long-Term Outcomes, and Genetic Profile-Review and Case Series. Genes (Basel) [Internet]. 22 de noviembre de 2020 [citado 3 de junio de 2024];11(11). Disponible en: https://doi.org/10.3390/genes11111383
7. Chkioua L, Amri Y, Chaima S, Fenni F, Boudabous H, Ben Turkia H, et al. Fucosidosis in Tunisian patients: mutational analysis and homology-based modeling of FUCA1 enzyme. BMC Med Genomics [Internet]. 23 de agosto de 2021 [citado 3 de junio de 2024];14(1):208. Disponible en: https://doi.org/10.1186/s12920-021-01061-3
8. Tamayo-Chang VJ, Llauradó-Robles RA, Campos-Hernández D, Monaga-Castillo M, Santana-Hernández EE. Fucosidosis en la Provincia Holguín. Causas y frecuencia. Rev Cubana Genet Comunit. [serie en internet] 2013; 7 (2): 33-37. Disponible en: https://www.medigraphic.com/pdfs/revcubgencom/cgc-2013/cgc132f.pdf.
9. Poorthuis BJ, Wevers RA, Kleijer WJ, Groener JE, de Jong JG, van Weely S, et al. The frequency of lysosomal storage diseases in The Netherlands. Hum Genet [Internet]. agosto de 1999 [citado 3 de junio de 2024];105(1-2):151-6. Disponible en: https://doi.org/10.1007/s004399900075
10. Lardoeyt Ferrrer R. Fundamentos de genética médica poblacional [Internet]. La Habana: Editorial Ciencias Médicas; 2016 [citado 27 de mayo de 2024]. 366 p. Disponible en: www.ecimed.sld.cu/2016/11/17/fundamentos-de-genetica-medica-poblacional
11. Centro de Estudios de Población y Desarrollo. ANUARIO DEMOGRÁFICO DE CUBA 2022 Edición julio 2023 [Internet]. Oficina Nacional de Estadísticas e Información de la República de Cuba (ONEI). [citado 9 de enero de 2024]. Disponible en: https://www.onei.gob.cu/anuario-demografico-de-cuba-enero-diciembre-2022
12. Kurihara C, Kerpel-Fronius S, Becker S, Chan A, Nagaty Y, Naseem S, et al. Declaration of Helsinki: ethical norm in pursuit of common global goals. Front Med (Lausanne) [Internet]. 2024 [citado 3 de junio de 2024]; 11:1360653. Disponible en: https://doi.org/10.3389/fmed.2024.1360653
13. Ben Turkia H, Tebib N, Azzouz H, Abdelmoula MS, Bouguila J, Sanhaji H, et al. Phenotypic spectrum of fucosidosis in Tunisia. J Inherit Metab Dis [Internet]. diciembre de 2008 [citado 3 de junio de 2024];31 Suppl 2:S313-316. Disponible en: https://doi.org/10.1007/s10545-008-0891-0
14. Waters D, Adeloye D, Woolham D, Wastnedge E, Patel S, Rudan I. Global birth prevalence and mortality from inborn errors of metabolism: a systematic analysis of the evidence. J Glob Health [Internet]. diciembre de 2018 [citado 3 de junio de 2024];8(2):021102. Disponible en: https://doi.org/10.7189/jogh.08.021102
15. Pinto R, Caseiro C, Lemos M, Lopes L, Fontes A, Ribeiro H, et al. Prevalence of lysosomal storage diseases in Portugal. Eur J Hum Genet [Internet]. febrero de 2004 [citado 3 de junio de 2024];12(2):87-92. Disponible en: https://doi.org/10.1038/sj.ejhg.5201044
16. Poupetová H, Ledvinová J, Berná L, Dvoráková L, Kozich V, Elleder M. The birth prevalence of lysosomal storage disorders in the Czech Republic: comparison with data in different populations. J Inherit Metab Dis [Internet]. agosto de 2010 [citado 3 de junio de 2024];33(4):387-96. Disponible en: https://doi.org/10.1007/s10545-010-9093-7
17. Al-Jasmi FA, Tawfig N, Berniah A, Ali BR, Taleb M, Hertecant JL, et al. Prevalence and Novel Mutations of Lysosomal Storage Disorders in United Arab Emirates: LSD in UAE. JIMD Rep [Internet]. 2013 [citado 3 de junio de 2024]; 10:1-9. Disponible en: https://doi.org/10.1007/8904_2012_182
18. Chin SJ, Fuller M. Prevalence of lysosomal storage disorders in Australia from 2009 to 2020. Lancet Reg Health West Pac [Internet]. febrero de 2022 [citado 3 de junio de 2024]; 19:100344. Disponible en: https://doi.org/10.1016/j.lanwpc.2021.100344
19. Giugliani R, Federhen A, Michelin-Tirelli K, Riegel M, Burin M. Relative frequency and estimated minimal frequency of Lysosomal Storage Diseases in Brazil: Report from a Reference Laboratory. Genet Mol Biol [Internet]. marzo de 2017 [citado 3 de junio de 2024];40(1):31-9. Disponible en: https://doi.org/10.1590/1678-4685-GMB-2016-0268
20. Puentes-Tellez MA, Lerma-Barbosa PA, Garzón-Jaramillo RG, Suarez DA, Espejo-Mojica AJ, Guevara JM, et al. A perspective on research, diagnosis, and management of lysosomal storage disorders in Colombia. Heliyon [Internet]. marzo de 2020 [citado 3 de junio de 2024];6(3): e03635. Disponible en: https://doi.org/10.1016/j.heliyon.2020.e03635
21. National Center for Biotechnology Information [Internet]. ClinVar; [VCV000000681.6]. [citado 8 de junio de 2024]. Disponible en: http://www.ncbi.nlm.nih.gov/clinvar/variation/VCV000000681.6
22. Maceira-Rozas MC, Atienza-Merino G. Detección precoz de mucopolisacaridosis y oligosacaridosis en el período neonatal mediante cribado poblacional: Revisión sistemática. Madrid, España: Ministerio de Sanidad y Consumo. Avalia-t No 2006/08. 2007. Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK74210/.
23. Mansilla-Roig B, Navío-Anaya M, Martínez-Sebastián A, Pons Morales S. Angioqueratomas: clave para el diagnóstico de un nuevo caso de Fucosidosis. I Congreso digital de la Asociación española de pediatría. 5-7 noviembre 2020. Disponible en: https://www.researchgate.net/publication/360354904.
24. Martínez-Rubio D, Hinarejos I, Sancho P, Gorría-Redondo N, Bernadó-Fonz R, Tello C, et al. Mutations, Genes, and Phenotypes Related to Movement Disorders and Ataxias. Int J Mol Sci [Internet]. 6 de octubre de 2022 [citado 3 de junio de 2024];23(19). Disponible en: https://doi.org/10.3390/ijms231911847
25. Bruno F, Laganà V, Di Lorenzo R, Bruni AC, Maletta R. Calabria as a Genetic Isolate: A Model for the Study of Neurodegenerative Diseases. Biomedicines [Internet]. 15 de septiembre de 2022 [citado 3 de junio de 2024];10(9). Disponible en: https://doi.org/10.3390/biomedicines10092288
26. Tournebize R, Chu G, Moorjani P. Reconstructing the history of founder events using genome-wide patterns of allele sharing across individuals. PLoS Genet [Internet]. junio de 2022 [citado 3 de junio de 2024];18(6): e1010243. Disponible en: https://doi.org/10.1371/journal.pgen.1010243
27. Xiao Q, Lauschke VM. The prevalence, genetic complexity and population-specific founder effects of human autosomal recessive disorders. NPJ Genom Med [Internet]. 2 de junio de 2021 [citado 3 de junio de 2024];6(1):41. Disponible en: https://doi.org/10.1038/s41525-021-00203-x
28. Sangiorgi S, Mochi M, Beretta M, Prosperi L, Costantino G, Romeo G. Genetic and demographic characterization of a population with high incidence of fucosidosis. Hum Hered [Internet]. 1982 [citado 3 de junio de 2024];32(2):100-5. Disponible en: https://doi.org/10.1159/000153267
29. Navarrete W, Díaz-Álvarez M F. Primeras familias, poblado y ciudad de San Isidoro de Holguín: Estudio de genealogía cubana. Miami: Ediciones UnosOtros, 2023.
30. Fortes-Lima C, Bybjerg-Grauholm J, Marin-Padrón LC, Gomez-Cabezas EJ, Bækvad-Hansen M, Hansen CS, et al. Exploring Cuba’s population structure and demographic history using genome-wide data. Sci Rep [Internet]. 30 de julio de 2018 [citado 3 de junio de 2024];8(1):11422. Disponible en: https://doi.org/10.1038/s41598-018-29851-3
LIMITACIONES
No fue posible la realización de estudios de haplotipos para profundizar en la caracterización del efecto fundador de la enfermedad.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses.
FUENTES DE FINANCIAMIENTO
No se contó con fuentes de financiamiento.
CONTRIBUCIÓN DE LOS AUTORES
Conceptualización: Víctor Jesús Tamayo Chang, Estela Morales Peralta, Elayne Esther Santana Hernández, Paulina Araceli Lantigua Cruz, Teresa Collazo Mesa, Roberto Lardoeyt Ferrer.
Análisis formal: Víctor Jesús Tamayo Chang, Estela Morales Peralta, Elayne Esther Santana Hernández, Paulina Araceli Lantigua Cruz, Teresa Collazo Mesa, Roberto Lardoeyt Ferrer.
Investigación: Víctor Jesús Tamayo Chang, Estela Morales Peralta, Elayne Esther Santana Hernández, Paulina Araceli Lantigua Cruz, Teresa Collazo Mesa, Roberto Lardoeyt Ferrer.
Redacción - borrador original: Víctor Jesús Tamayo Chang, Estela Morales Peralta, Elayne Esther Santana Hernández, Paulina Araceli Lantigua Cruz, Teresa Collazo Mesa, Roberto Lardoeyt Ferrer.
Redacción – revisión y edición: Víctor Jesús Tamayo Chang, Estela Morales Peralta, Elayne Esther Santana Hernández, Paulina Araceli Lantigua Cruz, Teresa Collazo Mesa, Roberto Lardoeyt Ferrer.
ANEXO
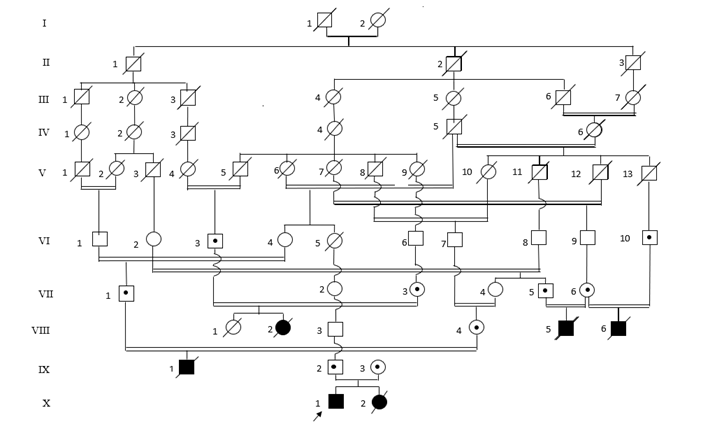
Figura 1. Árbol Genealógico 1. Familia
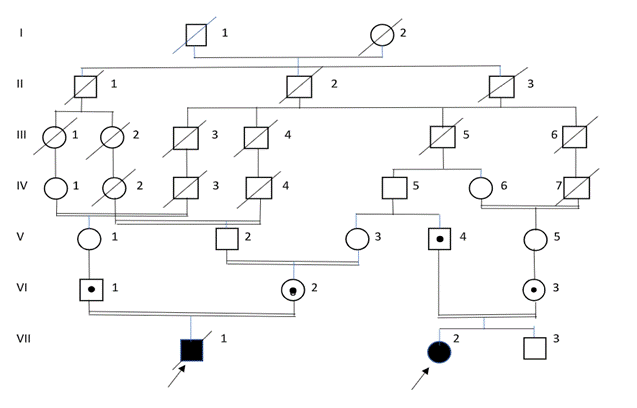
Figura 2. Árbol Genealógico 2. Familia L
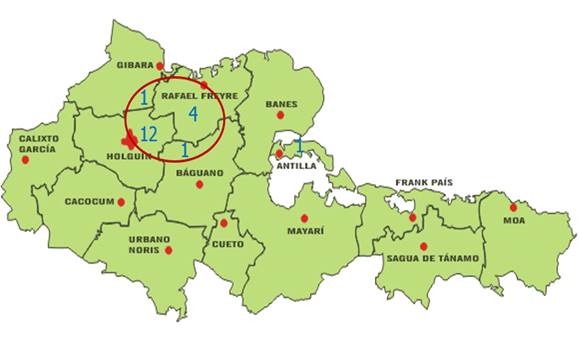
Figura 3. Distribución geográfica de los enfermos de fucosidosis según lugar de procedencia de las familias