Categoría: Health Sciences and Medicine
REVISIÓN SISTEMÁTICA
Ocrelizumab and its role in the treatment of multiple sclerosis: A systematic review of the literature
Ocrelizumab y su rol en el tratamiento de la esclerosis múltiple: Una revisión sistemática de la literatura
María Lucía Campos1 ![]() *,
Marcelo Adrian Estrin1
*,
Marcelo Adrian Estrin1 ![]() *
*
1Facultad de Medicina y Ciencias de la Salud, Universidad Abierta Interamericana. Argentina.
Citar como: Campos ML, Adrian Estrin MA. Ocrelizumab and its role in the treatment of multiple sclerosis: A systematic review of the literature. Salud, Ciencia y Tecnología - Serie de Conferencias. 2024; 3:924. https://doi.org/10.56294/sctconf2024924
Enviado: 08-02-2024 Revisado: 21-04-2024 Aceptado: 05-06-2024 Publicado: 06-06-2024
Editor: Dr.
William Castillo-González ![]()
ABSTRACT
Introduction: multiple Sclerosis is an autoimmune, chronic, progressive disease of the central nervous system that affects the myelin sheaths, producing a dysfunction in the nerve impulse, it is one of the main causes of neurological disability in young adults. Unfortunately, there is no cure for this disease, but there are many treatments to mitigate the outbreaks and progression of the disease. One of the promising drugs is ocrelizumab, a humanized monoclonal antibody against the CD20 antigen of B cells that has recently been approved by the US (Food and Drug Administration) and European (European Medicines Agency) health agencies for the treatment of sclerosis. multiplex (MS) and is the first drug to be marketed for both relapsingremitting MS (RRMS) and primary progressive MS (PPMS).
Material and methods: a bibliographic search will be carried out in the different scientific databases, in order to investigate the role of ocrelizumab in the treatment of Multiple Sclerosis.
Conclusion: MS is a disease that so far has no cure; however, a wide range of treatments are available that must be chosen according to the patient and his need. Within the vast range of treatment arises monoclonal antibodies that are specialized glycoproteins that are part of the immune system, produced by B cells, with the ability to recognize specific molecules (antigens). They are among the most promising agents for the treatment of MS. The most Used is ocrelizumab.
Keywords: Multiple Sclerosis; Illness; Monoclonal Antibody; Drug; Ocrelizumab.
RESUMEN
Introducción: la Esclerosis Múltiple es una enfermedad autoinmune, crónica , progresiva del sistema nervioso central que afecta las vainas de mielina, produciendo una disfunción en el impulso nervioso, es una de las principales causas de incapacidad neurológica en adultos jóvenes. Lamentablemente no existe cura para dicha enfermedad, pero existen muchos tratamientos para mitigar los brotes y la progresión de la enfermedad. Uno de los fármacos prometedores es el ocrelizumab, un anticuerpo monoclonal humanizado contra el antígeno CD20 de las células B que ha sido aprobado recientemente por las agencias sanitarias estadounidense (Food and Drug Administration) y europea (European Medicines Agency) para el tratamiento de la esclerosis múltiple (EM), y supone el primer fármaco comercializado tanto para la EM remitente recurrente (EMRR) como para la EM primariamente progresiva (EMPP).
Material y métodos: se realizará una búsqueda bibliográfica en las diferentes bases de datos científicas, a los fines de investigar el rol que cumple el ocrelizumab en el tratamiento de la Esclerosis Múltiple.
Conclusión: la EM es una enfermedad que hasta el momento no posee cura, sin embargo está disponible una amplia gama de tratamientos que deben ser elegidos de acuerdo al paciente y su necesidad. Dentro la vasta gama de tratamiento surge los anticuerpos monoclonales que son glucoproteínas especializadas que hacen parte del sistema inmune, producidas por las células B, con la capacidad de reconocer moléculas específicas (antígenos), están entre los agentes más prometedores para el tratamiento de la EM. Los más usados se encuentra el ocrelizumab.
Palabras Clave: Esclerosis Múltiple; Enfermedad; Anticuerpo Monoclonal; Fármaco; Ocrelizumab.
INTRODUCCIÓN
La esclerosis múltiple (EM) es una enfermedad autoinmune inflamatoria desmielinizante, neurodegenerativa, crónica y progresiva sin cura del sistema nervioso central(SNC) predominantemente mediado por células T, que inducen desmielinización multifocal y gliosis con pérdida de oligodendrocitos y axones. Es el resultado de una interacción compleja entre la susceptibilidad genética y factores ambientales no tan conocidos que provocarían células T autorreactivas que, tras un periodo de latencia –10 a 20 años según algunos autores– serían activadas por un factor sistémico o local. Esto originaría una reacción autoinmune que desencadenaría la reacción de inflamación y desmielinización. No está clara la naturaleza de este factor, aunque se considera que estarían implicadas enfermedades virales y autoinmunes, que serían las que inducirían la formación de placas.(1,2)
Al parecer los CD4+ activados se adhieren a la superficie de las células endoteliales de los vasos del SNC y migran hacia el SNC atravesando la barrera hematoencefálica. Esto se continúa con una amplificación de la respuesta inmune tras el reconocimiento de antígenos específicos en las células presentadoras de antígenos que se acompaña de otros factores como autoanticuerpos o citoquinas. Los anticuerpos contra los antígenos que se encuentran en la sustancia blanca y oligodendrocitos pueden causar la desmielinización directamente por inmunidad celular, bien por la activación del complemento que induciría una citólisis, encontrándose fragmentos de anticuerpos contra la proteína básica de la mielina en los pacientes afectos de EM o bien indirectamente por inmunidad humoral induciendo la activación de macrófagos y células de la microglía que por medio del complejo trimolecular –formado por receptores de la célula T, antígenos y receptores de la molécula HLA clase II– producirían citoquinas, como el factor a de necrosis tumoral y el interferón g que generarían reacciones de nitro oxigenación produciendo aminoácidos, componentes del complemento o enzimas proteolíticas y lipolíticas.(2,3)
Otros factores también implicados en la toxicidad de los oligodendrocitos serían productos solubles de las células T, como la perforina, la interacción del antígeno Fas con su ligando, la interacción de CD8+ con el complejo mayor de histocompatibilidad I, la infección viral persistente, siendo de éstas la más frecuente la producida por el herpes virus tipo 6, que incluso en sujetos normales puede dar una clínica que remeda la EM.(2,4)
Uno de los factores que se cree que es la causa de la esclerosis múltiple es el factor ambiental en si , como la frecuencia que no es la misma en todos los continentes, ya que la incidencia aumenta en Europa, América del Norte y Oceanía con predominio en raza blanca. Otro factor importante es la vitamina D , se demostró que paciente con niveles disminuidos de vitamina D presentan una mayor predisposición a desarrollar la EM en su forma más complicada.(1)
La edad y el sexo también son factores predisponentes , estudios demuestran que el rango etario abarca adultos jóvenes desde los 20 hasta los 40 años y es más común en el sexo femenino sugiriendo que las hormonas podrían desempeñar un papel importante en la enfermedad.(2,5) La EM también puede ser inducida por el tabaquismo y el estrés.
Estos factores que actúan en la perdida de mielina afectan la transmisión del impulso nervioso, lo ralentizan y hacen que los axones se desgasten más rápido y consecuentemente haya una reducción en la capacidad del cerebro para comunicarse con otras partes del cuerpo.
Como conclusión, se piensa que en aquellos sujetos genéticamente predispuestos sobre los que incide cierto factor ambiental desconocido, se ponen en marcha una cascada de reacciones inmunes de tipo humoral que desencadenan el brote de EM.(2)
El primer reporte de un caso de Esclerosis Múltiple (EM) parece haber sido de una devota católica holandesa que vivió en el siglo XIV, llamada Lidwina de Schiedam (1380-1433), a la edad de dieciséis años, sufrió una caída mientras patinaba que le provocó una lesión costal, de allí comenzó con quejas recurrentes muy sugestivas de EM; dolor facial severo, déficit motor en miembros inferiores y alteraciones visuales. A los diecinueve años ya estaba parapléjica y con dificultad visual permanente, su condición clínica fue empeorando paulatinamente hasta su muerte a los 53 años.(6)
En el año de 1868 Jean-Martin Charcot, un neurólogo francés hizo la primera descripción clínica y anatómica de la enfermedad, detallando de forma precisa las alteraciones patológicas post mortem, de esa manera describió una publicación de las más importantes sobre el tema que identificaba la EM que antes era confundida con una parálisis.(6)
La EM es una de las principales causas de discapacidad neurológica de origen no traumático en adultos jóvenes, principalmente mujeres, afectando entre 2,3 % y 2,5 % millones de personas en el mundo según un estudio realizado por la OMS en 2008.(5,7)
En el 85 % de los casos, la enfermedad se manifiesta inicialmente con un curso de brotes seguidos de remisiones totales o parciales, etapa denominada esclerosis múltiple con recaídas y remisiones (EMRR), y es la fase de la enfermedad que mejor respuesta clínica presenta a las intervenciones terapéuticas disponibles. Eventualmente, el curso clínico de la enfermedad evoluciona, mostrando un deterioro neurológico progresivo independiente de las recaídas y remisiones con una respuesta limitada a los tratamientos, y se denomina esclerosis múltiple secundaria progresiva (EMSP), la otra etapa de la enfermedad la esclerosis múltiple progresiva recidivante (EMPR) caracterizada por brotes desde el inicio de la enfermedad que va evolucionando progresivamente y a cada crisis hay una mayor evolución de la discapacidad del enfermo. Finalmente, en un grupo reducido de pacientes la enfermedad presenta desde su diagnóstico un curso de deterioro progresivo de la función neurológica, referido como esclerosis múltiple progresiva primaria (EMPP).
En cuanto la clínica no existe un patrón clínico de presentación. La característica clínica que mejor la define es la variabilidad, al depender de la localización de las lesiones desmielinizantes pero hay algunos conceptos a tener en cuenta en esta enfermedad.
|
Tabla 1. Conceptos de la Esclerosis Multiple |
|
Conceptos acerca de la EM (Esclerosis Múltiple) (POSER)
Brote: Se considera la aparición de síntomas de disfunción neurológica de más de 24 horas. Éste es un dato que puede ser recogido o referido por algún familiar o acompañante del enfermo. El tiempo entre dos brotes no debe ser inferior al mes, presentándose en muchas ocasiones con distintos síntomas. Remisión: Es la mejoría hasta la desaparición de los síntomas presentes al menos durante 24 horas, permaneciendo al menos 1 mes libre de síntomas. Lesiones separadas: Son aquéllas que aparecen en distintas localizaciones del neuroeje, con un periodo mínimo de 15 días entre ellas. Exclusión: Son síntomas secundarios a la alteración del sistema nervioso periférico que no se aceptan como componentes de un brote, así como cefaleas de tipo migraña o mixtas, depresiones, convulsiones o alteraciones de la conciencia. Evidencia clíncia: Presencia de algún signo clínico anormal en la exploración neurológica, aunque sea registrado por la historia clínica. Se debe demostrar como una lesión del SNC ha producido síntomas por medio de una correcta valoración neurológica, técnicas de neuroimagen y potenciales evocados. |
El síntoma de comienzo más frecuente es la alteración de la sensibilidad, hasta un 4045 % de los pacientes presentan esta forma.
Consiste en parestesias de 1 o más miembros debido a la alteración del haz espinotalámico. Hasta en un 40 % aparece una alteración motora, caracterizada por la pérdida de fuerza en 1 o más miembros, especialmente los inferiores, produciendo una marcha en la que apenas se elevan las piernas, como de arrastre. Además, pueden aparecer paresias o parálisis francas e hiperreflexias osteotendinosas.(2)
La depresión es el trastorno psiquiátrico más común en la EM. En estos pacientes la depresión se caracteriza por irritabilidad, fatiga, insomnio, perdida del apetito, sensación de culpa, disfunción sexual, perdida de la memoria y un aumento del riesgo de suicidio de hasta 7 veces en relación a otras enfermedades neurológicas. Otros síntomas menos frecuentes son los producidos como consecuencia de la disfunción del tronco cerebral, como la disartria, disfagia, parálisis facial nuclear o vértigo. Es bastante típica la aparición de un nistagmo horizontal, vertical o rotatorio que puede ser un signo casi patognomónico de EM en jóvenes. Las alteraciones visuales son por afección del nervio o el quiasma; es frecuente la existencia de un escotoma central con una disminución de la agudeza visual. El fondo de ojo puede ser normal (neuritis retrobulbar), o presentar edema de papila o el signo de Marcus-Gunn. Por último, menos frecuentemente, la EM puede debutar con disartria, incoordinación motora o inestabilidad de la marcha, temblor intencional, dismetría, disadiococinesia o ataxia de los miembros alteración de los esfínteres o deterioro mental.(2,8) (figura 2)
El diagnóstico de EM está relacionado con los síntomas de los pacientes, la RM y los resultados de laboratorio, pero la EM sólo puede diagnosticarse en la fase tardía.(5) Los criterios de McDonald son criterios de diagnóstico para la esclerosis múltiple (EM), estos criterios se nombran después por el neurólogo Ian Macdonald, son nuevos criterios destinados a sustituir los criterios de Poser y el criterio de Schumacher que son más antiguos, la última actualización fue realizada en 2017.
Los criterios de McDonald mantuvieron un esquema para diagnosticar la EM basado únicamente en fundamentos clínicos, pero también propusieron por primera vez que cuando falta evidencia clínica, los hallazgos de la resonancia magnética pueden servir como sustitutos para la diseminación en el espacio (DIS) y / o en el tiempo (DIT) para diagnosticar la EM. Los criterios intentan probar la existencia de lesiones desmielinizantes, por imagen o por sus efectos, demostrando que ocurren en diferentes áreas del sistema nervioso (DIS) y que se acumulan en el tiempo (DIT). Los criterios de McDonald facilitan el diagnóstico de EM en pacientes que presentan su primer ataque desmielinizante y aumentan significativamente la sensibilidad para diagnosticar la EM sin comprometer la especificidad.(9)
LCR: Macroscópicamente es normal en la EM. Sin embargo, al análisis microscópico se puede objetivar una elevación relativa de las inmunoglobulinas, sobre todo de la Ig G. El índice Ig G en condiciones normales es inferior a 0,66. Además pueden aparecer bandas de células plasmáticas, las denominadas bandas oligoclonales (BOC), detectadas por isoelectroenfoque en gel de policramida, que se pueden observar hasta en un 95 % de los pacientes, aunque pueden existir falsos positivos para otras enfermedades, como infecciones virales o crónicas del SNC, el síndrome de Guillain-Barré u otras.(10)
Potenciales Evocados: son estímulos sensoriales que se generan en el SNC tras la estimulación de un órgano sensitivo/sensorial periférico. Los más utilizados son los visuales (PEV), con una sensibilidad de hasta un 95 %, los somatosensoriales (PESS) con una sensibilidad del 75 % y por último los menos sensibles son los auditivos del tronco (PET). En pacientes con EM la respuesta del cerebro a los estímulos puede ser lenta, por la conducción de las señales a lo largo de las fibras nerviosas diesmilinizadas. Cuanto mayor es la perdida de mielina más lenta será la transmisión de impulsos nerviosos. Resonancia magnética nuclear (RMN): es la prueba más sensible y especifica, sirve para determinar la extensión de las lesiones, y diferenciar la naturaleza aguda (lesiones que aparecen como hipointensas en T1, un tipo de proyección con gadolinio) o crónica (lesiones hiperintensas en T2). En muchas ocasiones estas imágenes preceden a la aparición de síntomas clínicos. Se han desarrollado múltiples criterios con el fin de confirmar el diagnóstico; la presencia de 3-9 lesiones, de 3-6 mm de diámetro y localización periventricular, yuxtaventricular o en fosa posterior y que al menos una de ellas capte el radioisótopo gadolinio.
Una RM cerebral debe obtenerse en todo paciente con un cuadro clínico indicativo de corresponder a un primer brote de origen desmielinizante. En esta situación la RM debe realizarse con carácter preferente, y siempre que sea posible, antes de iniciar el tratamiento corticoide, ya que éste suprime temporalmente el realce con el contraste de las lesiones activas.
En pacientes en que el cuadro se inicia con un síndrome medular, debe realizarse, además del estudio de RM cerebral, una RM medular con el objeto de confirmar la lesión desmielinizante sintomática y descartar lesiones causales de otro origen. La RM medular (especialmente del segmento cervical) también está indicada cuando los hallazgos de la RM cerebral no sean concluyentes.(11)
La RMN craneal detecta lesiones hasta en un 95 % y la cérvico-medular hasta en un 75 % de los casos, informa indirectamente acerca de la histopatología, puesto que el paso de contraste a través de la barrera hematoencefálica significa que está permeable, y que se está produciendo inflamación. Existe alguna correlación entre la RMN y la progresión de la enfermedad que no es muy clara y se hace difícil de prever el desarrollo de la EM.
La EM es una enfermedad que hasta el momento no posee cura, sin embargo se dispone de una amplia gama de tratamientos que deben ser elegidos de acuerdo al paciente y su necesidad. Los tratamientos ofrecidos actualmente para la esclerosis intentan reducir la actividad inflamatoria de los brotes , permitiendo una mejoría en la calidad de vida del paciente y una reducción en la incapacidad adquirida a lo largo de los años. El tratamiento se concreta básicamente en tres pilares: tratamientos farmacológicos con base inmunológica para evitar y retardar la aparición de brotes, el tratamiento sintomático y rehabilitador, y otras formas de tratamiento.
En el tratamiento farmacológico se encuentran:
· Los glucocorticoides: Su mecanismo de acción es inhibir la proliferación de los linfocitos T actuando en la supresión de las citoquinas restaurando la barrera hematoencefálica.(2)
· Inmunomoduladores: Es considerado por los científicos el tratamiento indicado tras el primer brote. Su uso es indicado en la EMRR y EMSP. Ellos son acetato de glatirámero, teriflunomida, interferón beta I a y I b.(2)
· Inmunosupresores: El tratamiento de inmunosupresores empezó en la década de 60 y es utilizado en las formas EMRR, EMPP y EMPS. Los principales inmunosupresores son la ciclofosfamida ,azatioprina, metotrexato, ciclosporina, cladribina, fingolimod y mitoxantrone.(2,12)
· Inmunoglobulina humana: Existe controversia en la esclerosis múltiple, sin embargo existen estudios clínicos donde se demuestra beneficio en la reducción de las exacerbaciones en 34 % comparado con 15 % del grupo placebo, como función principal se ha encontrado remielinización espontánea y efectos inhibitorios de macrófagos y de otras células antiinflamatorias.(13)
· Plasmaféresis : El término plasmaféresis se utiliza como sinónimo de recambio plasmático (RP): extracción de gran volumen de plasma y substitución por soluciones coloides o cristaloides (la albúmina sérica normal suele ser el producto más utilizado). A pesar de la falta de base fisiopatológica y ante la no existencia de otras alternativas terapéuticas definitivas no es infrecuente que se ofrezca a pacientes con esclerosis múltiple (EM) en forma progresiva la posibilidad de tratamiento con plasmaféresis en un «desesperado» intento de frenar la evolución.(14) La plasmaféresis permite la eliminación directa de autoanticuerpos y otros factores inflamatorios presentes en el plasma, lo que explica la mejoría clínica en brotes.
A pesar de ello el tratamiento con plasmaféresis se justificaría por los siguientes hechos:
1. Alteración precoz de la barrera hematoencefálica.
2. Distribución perivascular de las lesiones iniciales.
3. Aumento de IgG en las lesiones.
4. Asociación de anomalías inmunológicas.
5. Cierta efectividad de la medicación inmunosupresora.
6. Ausencia de otras alternativas terapéuticas.
· Estatinas y Vitamina D: Estudios demuestran que las estatinas poseen un efecto antiinflamatorio e inmunomodulador debido a la acción inhibitoria en el óxido nítrico sintetasa que es toxico para los oligodendrocitos. En el caso de la vitamina D se descubrió que pacientes con EM presentan bajas concentraciones en la sangre y tienden a desarrollar la forma más grave de la EM.
· Anticuerpos monoclonales: Los anticuerpos monoclonales son glucoproteínas especializadas que hacen parte del sistema inmune, producidas por las células B, con la capacidad de reconocer moléculas específicas (antígenos).Están entre los agentes más prometedores para el tratamiento de la EM.
Los más usados son: daclizumab, alemtuzumab rituximab y el ocrelizumab.
El ocrelizumab es una nueva droga que ayuda a reducir de forma significativa el número de crisis (brotes) y ralentizar de forma significativa la progresión de la enfermedad. Este fármaco ha demostrado ser eficaz en pacientes con formas progresivas de la enfermedad además de ser el primer fármaco aprobado por la Food and Drug Administration y la European Medicines Agency para el tratamiento de la EM con ambos fenotipos, EMPP y EMRR.(15,16)
Si bien el ocrelizumab es el primer tratamiento que ha mostrado eficacia en pacientes con formas progresivas, el efecto real sobre la progresión de la discapacidad es modesto, y la relevancia clínica a largo plazo en pacientes con formas progresivas está aún por definir.(16)
Sin embargo, desde hace décadas se especula con el papel de los linfocitos B. Las bandas oligoclonales presentes en la mayoría de los pacientes con EM han sido siempre uno de los argumentos más sólidos a la hora de defender un papel activo de la célula B en la enfermedad. Hoy en día se sabe que el plasmablasto activado, derivado del linfocito B, puede permanecer en el líquido cefalorraquídeo del paciente con EM durante períodos muy prolongados, a diferencia de lo que ocurre en otras enfermedades del sistema nervioso central, como, por ejemplo, las infecciones. Esta célula sería la responsable de la secreción de inmunoglobulinas y bandas oligoclonales, un marcador independiente del pronóstico de la enfermedad a medio plazo.(14) La mayoría de los tratamientos aprobados para la EM tienen un efecto directo o indirecto sobre el control de las funciones de las células T, y gran parte de ellos ejercen parcialmente su mecanismo de acción actuando también sobre las células B. La actualización de los conocimientos sobre la enfermedad ha permitido el desarrollo de terapias frente a esta estirpe celular. Los anticuerpos antiCD20 provocan una destrucción de células B circulantes CD20+ que se prolonga durante más de medio año. Sin embargo, se desconoce hasta qué punto estas terapias actúan de forma efectiva sobre las células B del sistema nervioso central, sobre el tejido linfoide y sobre la médula ósea.(17)
El beneficio del ocrelizumab en pacientes con formas de EMRR, al igual que ocurre con otros fármacos para esta indicación, es más fácilmente explicable: pacientes con actividad, con una barrera hematoencefálica abierta y un mecanismo de acción del fármaco que, aunque predomine en la periferia, logra una repercusión directa sobre el sistema nervioso central, bloqueando indirectamente el fenómeno inflamatorio, la neoformación de lesiones y la aparición de clínica aguda.(16) El perfil de seguridad del ocrelizumab no ofrece datos llamativos. Los fármacos biológicos previos han ido abriéndonos el camino y, en la actualidad, la incertidumbre sobre el desarrollo de ciertas infecciones o neoplasias en el contexto de estos tratamientos es algo con lo que conviven profesionales y pacientes, y se intenta controlar ajustándonos a los planes de minimización de riesgos.(16)
El ocrelizumab abre una nueva etapa en el tratamiento de la EM, y esto, además de un efecto directo sobre la calidad de vida de los pacientes, llevará a una mejora en la comprensión de la enfermedad y en la forma de abordarla en un futuro.(16)
MATERIALES Y MÉTODOS
Para esta revisión sistemática de bases bibliográficas se realizó una búsqueda exhaustiva sistemática sin restricciones de idioma desde la década de 90 hasta el presente momento, usando las siguientes bases de datos electrónicas: PUBMED, SCIELO, ELSEVIER Y COCHARNE. De la extensa literatura fueron seleccionados 22 artículos y al final se incluyeron 17 artículos para esta revisión sistemática. Finalmente, se consultó a los investigadores con experiencia en el tema para abarcar la identificación de posibles estudios de potenciales. Los términos usados MESH utilizados para la búsqueda incluyeron: “Múltiple Eclerosis”; “Illness”; “Monoclonal Antibody”; “Ocrelizumab”; “Drug”. Fueron seleccionados estudios de revisiones sistemáticas , revisiones y caso control con el objetivo de llevar a cabo lo propuesto en el estudio. Se evaluaron los títulos y los resúmenes de todas las referencias preseleccionadas identificadas y seleccionaron los estudios potenciales. Posteriormente, se evaluaron los textos completos de dichos estudios para determinar la inclusión de los mismos.
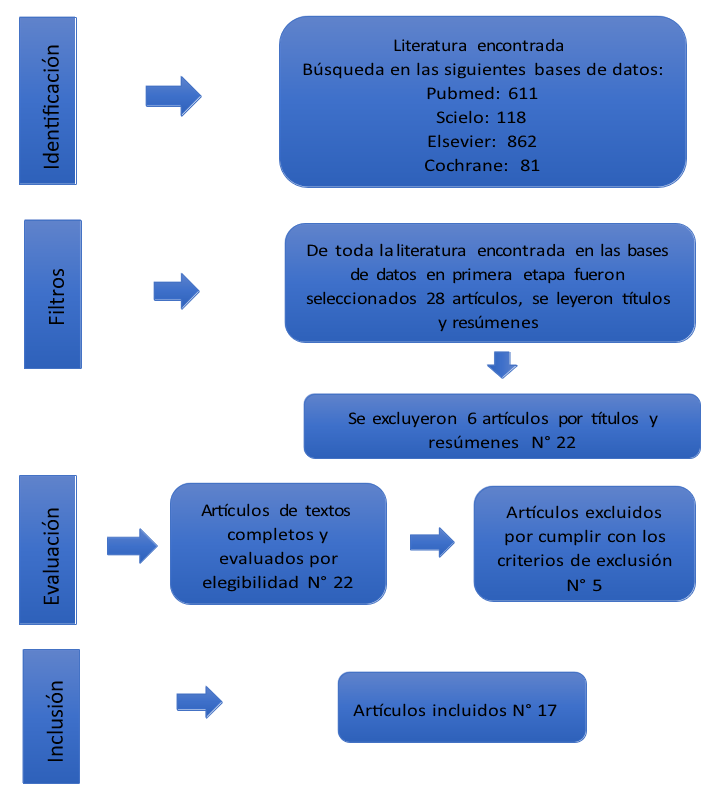
Figura 1. Proceso de identificación de los estudios incluidos
A continuación, se utilizaron los siguientes criterios de inclusión:
Criterios de Inclusión
· Literatura científica de pacientes con Esclerosis Múltiple y sus formas clínicas.
· Literatura científica de pacientes tratados con ocrelizumab.
· Literatura científica de pacientes con EM en el rango etario.
De la misma manera se aplicaron estos criterios de exclusión:
Criterios de Exclusión
· Literatura científica de pacientes ancianos y pediátricos con EM con sus formas clínicas y tratamiento.
· Literatura científica que aborde exclusivamente la calidad de vida de pacientes con EM.
· Literatura científica que excluya los anti monoclonales como tratamiento.
Cualquier discrepancia fue resuelta por consenso en ambas fases. Se evaluó la calidad metodológica usada en los estudios incluidos en la revisión sistemática y se fundamentó principalmente en estudios de investigación sobre aspectos epidemiológicos de la EM en los cuales fue posible realizar una completa evaluación de la calidad de cada estudio incluido.
La población objetivo de este proyecto está compuesta por la literatura científica sobre la esclerosis múltiple, sus formas clínicas y el tratamiento, en especial nuevas terapéuticas como el anticuerpo monoclonal Ocrelizumab.
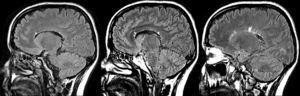
Figura 2. Resonancia magnética cerebral
Fuente: Rovira A, Izquierdo G.(11)
En la figura 2 se observa una secuencia FAST-FLAIR en el plano sagital en un paciente con un primer episodio clínico con posible origen desmielinizante. Se observan lesiones focales hiperintensas periventriculares y en la superficie subependimaria del cuerpo calloso.
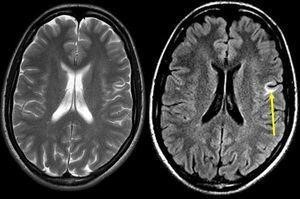
Figura 3. Resonancia magnética cerebral
Fuente: Rovira A, Izquierdo G.(11)
La figura 3 muestra las secuencias ponderadas en T2 con eco largo y FAST-FLAIR en el plano transversal en un paciente con esclerosis múltiple clínicamente definida. Se observa una lesión yuxtacortical frontal izquierda, que afecta las fibras en U. La lesión se objetiva mejor en la secuencia FAST-FLAIR (derecha) que con la secuencia fast-T2 (flecha).
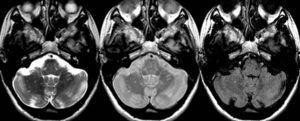
Figura 4. Resonancia magnética cerebral
Fuente: Rovira A, Izquierdo G.(11)
En la figura 4 se aprecia secuencias ponderadas en T2 (izquierda), densidad protónica (centro) y fast-FLAIR (derecha) en el plano transversal en un paciente con esclerosis múltiple clínicamente definida. Se observan múltiples y pequeñas lesiones desmielinizantes, muchas de ellas no visibles en la secuencia FAST-FLAIR.
RESULTADOS
La esclerosis múltiple (EM) es una enfermedad autoinmune caracterizada por la inflamación, desmielinización y neurodegeneración del sistema nervioso central. Suele iniciarse entre los 20-40 años y es la primera causa de discapacidad no traumática en personas jóvenes.(14)
Uno de los factores que se cree que es la causa de la esclerosis múltiple es el factor ambiental en si , como la frecuencia que no es la misma en todos los continentes, ya que la incidencia aumenta en Europa, América del Norte y Oceanía con predominio en raza blanca.(1) La edad y el sexo también son factores predispuestos , estudios demuestran que rango etario abarca adultos jóvenes desde los 20 hasta los 40 años y es más común en el sexo femenino.(2)
La EM es una de las principales causas de discapacidad neurológica de origen no traumático en adultos jóvenes, principalmente mujeres, afectando a entre 2,3 % y 2,5 % millones de personas en el mundo según un estudio realizado por la OMS en 2008.(7,5 %). En la mayoría de los casos la enfermedad se manifiesta inicialmente con un curso de brotes seguidos de remisiones totales o parciales.
Dentro de los tipos de EM están la EMRR (esclerosis múltiple con recaídas y remisiones), EMSP(esclerosis múltiple secundaria progresiva) que es el agravamiento de la EMRR y tarda como 10 años en progresar; ya la EMPP(esclerosis múltiple progresiva primaria) es diagnosticada más tardíamente y es un cuadro más grave, el agravamiento de los síntomas es progresivo y el paciente va dejando de tener brotes o surtos puntuales para una manifestación más continua de las alteraciones. Por fin la EMPR(esclerosis múltiple recurrente progresiva) el tipo más raro y agresivo.
Clínicamente no existe una presentación especifica, pero los principales síntomas son: fatiga, alteraciones auditivas, incoordinación motora, espasticidad trastornos visuales, cognitivos, psíquicos siendo la depresión el trastorno más común en la EM y consecuentemente un aumento del riesgo de suicidios.
Actualmente el diagnóstico de la EM se basa en la clínica y se confirma con Resonancia Magnética por su sensibilidad y especificidad ya que determina la extensión de las lesiones, y diferenciar la naturaleza aguda (lesiones que aparecen como hipointensas en T1, un tipo de proyección con gadolinio) o crónica (lesiones hiperintensas en T2).
La EM es una enfermedad que hasta el momento no posee cura, sin embargo, está disponible una amplia gama de tratamientos que deben ser elegidos de acuerdo al paciente y su necesidad. Los tratamientos ofrecidos actualmente para la esclerosis intentan reducir la actividad inflamatoria de los brotes , permitiendo una mejoría en la calidad de vida del paciente y una reducción en la incapacidad adquirida. A pesar de este amplio arsenal terapéutico, un porcentaje considerable de pacientes sigue presentando brotes, y hasta un 59 % sufre un empeoramiento significativo de su discapacidad. Esto nos lleva a una carrera terapéutica en la que aún faltan muchos hitos por alcanzar.(14)
Dentro la vasta gama de tratamiento surge los anticuerpos monoclonales que son glucoproteínas especializadas que hacen parte del sistema inmune, producidas por las células B, con la capacidad de reconocer moléculas específicas (antígenos). Están entre los agentes más prometedores para el tratamiento de la EM. Los más usados son: daclizumab, alemtuzumab rituximab y el ocrelizumab.(14)
El ocrelizumab es una nueva droga que ayuda a reducir de forma significativa el número de crisis (brotes) y ralentizar de forma significativa la progresión de la enfermedad. Este fármaco promisor demuestra eficacia en pacientes con formas progresivas de la enfermedad además es el primer fármaco aprobado por la Food and Drug Administration y la European Medicines Agency para el tratamiento de la EM con ambos fenotipos, EMPP y EMRR.(13,14)
Un ensayo clínico aleatorizado Opera I y II doble ciego que testeo ocrelizumab en pacientes con EMRR el primero incluyo 220 pacientes durante 6 meses hubo una reducción significativa en las lesiones. Además, el ocrelizumab es probablemente más potente que su predecesor y una dosis de 600 mg sería biológicamente superior a una dosis de 1 000 mg de rituximab.
Los efectos adversos más frecuentes en pacientes que recibieron ocrelizumab fueron las reacciones infusiónales, las infecciones del tracto urinario, las nasofaringitis y las infecciones respiratorias de las vías altas.
Otro efecto adverso detectado fueron las reactivaciones del virus de la hepatitis B (VHB) en pacientes que recibieron anticuerpos antiCD20 y que tuvieron como consecuencia hepatitis fulminante, fallo hepático y muerte. Su uso estaría contraindicado en el caso de infección activa.(14)
Durante la fase de desarrollo del ocrelizumab en la EM se testaron dosis de 600 y 2 000 mg. El fallecimiento de una paciente en el brazo de mayor dosis, debido a un síndrome de respuesta inflamatoria sistémica, motivó que la investigación prosiguiera únicamente para la dosis de 600 mg. En cuanto a embarazo el ocrelizumab, no cruzan la placenta durante el primer trimestre de embarazo y se presupone que sólo se produce transferencia materno fetal a partir de la semana. Por todo ello, el feto estaría teóricamente protegido de la exposición al ocrelizumab durante la organogenia. Además, la vida media del ocrelizumab en la sangre es de 26 días y la semivida de eliminación es de 4,5 meses.(14)
El ocrelizumab abre una nueva etapa en el tratamiento de la EM, y esto, además de un efecto directo sobre la calidad de vida de los pacientes, llevará a una mejora en la comprensión de la enfermedad y en la forma de abordarla en un futuro.(14)
DISCUSIÓN
La esclerosis múltiple (EM) es una enfermedad Neuroinflamatoria y neurodegenerativa crónica que es una de las principales causas de discapacidad neurológica en adultos jóvenes y existe un aumento del riesgo de suicidio en comparación con otras enfermedades neurológicas y la población general. Se presenta más comúnmente en forma de recaídas-remisiones, en las que el curso clínico se caracteriza por síntomas neurológicos agudos (recaídas) separados por períodos de relativa inactividad (remisión). Los síntomas neurológicos agudos típicos incluyen (pero no se limitan a) deficiencias visuales, sensoriales y motoras. La recuperación de las recaídas puede ser incompleta y la discapacidad generalmente aumenta con el tiempo. En consecuencia, la capacidad de identificar a las personas con EM en las primeras etapas del curso de su enfermedad es de gran interés, ya que permitiría el inicio inmediato de intervenciones diseñadas para prevenir las recaídas y la discapacidad a largo plazo.
Todavía seguimos distantes de un abordaje curativo, pero los avances recientes son alentadores ya que prometen ofrecer un tratamiento relativamente efectivo para los portadores de la EM. Por tal motivo, el ocrelizumab es el primer fármaco antimonoclonal que ha demostrado poder enlentecer de forma significativa la progresión de la discapacidad en 12 y 24 semanas en pacientes con EMPP. Es también eficaz en el control de la actividad clínica y radiológica en pacientes con formas de EMRR, y su aprobación e indicación engloban ambos fenotipos de la enfermedad. Hasta ahora, el perfil de seguridad del ocrelizumab se ajusta a lo observado en los ensayos clínicos, sin alertas inesperadas. El ocrelizumab abre una nueva etapa en el tratamiento de la EM, y esto, además de un efecto directo sobre la calidad de vida de los pacientes, llevará a una mejora en la comprensión de la enfermedad y en la forma de abordarla en un futuro. Mas que la cura de la enfermedad , se hace necesario trabajar con varias disciplinas de la salud , a fin de mejorar la calidad de vida de estos pacientes y preparar el entorno familiar que por muchas veces no tiene el conocimiento de la progresión de la enfermedad. Sin embargo, las perspectivas a largo plazo son alentadoras.
REFERENCIAS
1. Cuevas-García CF, Segura-Méndez NH, Herrera-Sánchez DA. Current advances in multiple sclerosis immunopathology. Gac Med Mex. 2018;154(5):498–506.
2. Carretero Ares JL, Bowakim Dib W, Acebes Rey JM. Actualización: Esclerosis múltiple. MEDIFAM - Rev Med Fam y Comunitaria. 2001;11(9):516–29.
3. Jersild C, Hansen GS, Svejgaard A, Fog T, Thomsen M, Dupont B. Histocompatibility Determinants in Multiple Sclerosis, With Special Reference To Clinical Course. Lancet. 1973;302(7840):1221–5.
4. Cook SD, Rohowsky‐Kochan C, Bansil S, Dowling PC. Evidence for multiple sclerosis as an infectious disease. Acta Neurol Scand. 1995;91(161 S):34–42.
5. Koriem KMM. Corrigendum to ‘Multiple sclerosis: New insights and trends’ (Asian Pacific Journal of Tropical Biomedicine (2017) 7(5) (493–504) (S2221169116302453) (10.1016/j.apjtb.2016.03.009)). Asian Pac J Trop Biomed [Internet]. 2017;7(5):493–504. Available from: http://dx.doi.org/10.1016/j.apjtb.2017.02.001
6. Cases E, Sclerosis M. The History of MS. 1868;1–11.
7. Hegen H, Bsteh G, Berger T. ‘No evidence of disease activity’ – is it an appropriate surrogate in multiple sclerosis? Eur J Neurol. 2018;25(9):1107-e101.
8. CM P, DW P, Scheinberg L, WI M, FA D, GC E, et al. New diagnostic criteria for multiple sclerosis: guidelines for research protocols. Ann Neurol. 1983;13(3):227–31.
9. Thompson AJ, Banwell BL, Barkhof F, Carroll WM, Coetzee T, Comi G, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol. 2018;17(2):162–73.
10. Andersson M, Alvarez-Cermeñio J, Bernardi G, Cogato I, Fredman P, Frederiksen J, et al. Cerebrospinal fluid in the diagnosis of multiple sclerosis: A consensus report. J Neurol Neurosurg Psychiatry. 1994;57(8):897–902.
11. Rovira A, Izquierdo G. Recomendaciones para la utilización e interpretación de los estudios de resonancia magnética en la esclerosis múltiple. 2010;25(4).
12. Bargiela NF, García CM, Arufe VG, Hermida JRV, Herranz IM. Fingolimod in multiple sclerosis: Profile of use in habitual practice. Eur J Hosp Pharm. 2020;27(6):346–9.
13. Mogica-Martínez MD. Uso terapéutico actual de la inmunoglobulina intravenosa. Rev Med Inst Mex Seguro Soc. 2006;44(2):81–6.
14. Castro P De. Plasmaféresis en la esclerosis múltiple. :57–62.
15. Sospedra M. Inmunoterapias en esclerosis múltiple. :71–80.
16. Juanatey A, Blanco-garcía L, Téllez N. Bt120423. 2018;66(12):423–33.
17. Roll P, Palanichamy A, Kneitz C, Dorner T, Tony HP. Regeneration of B cell subsets after transient B cell depletion using anti-CD20 antibodies in rheumatoid arthritis. Arthritis Rheum. 2006;54(8):2377–86.
AGRADECIMIENTOS
Un año que comienza un nuevo principio y es que por fin puedo decir que llego mi momento más soñado, tantos años anhelando este sueño que no creo estar concluyéndolo.
Quiero agradecer a mi Tutor, Marcelo Adrian Estrin. Gracias por estar predispuesto a ayudarme cuando mis horas se hacían confusas. Gracias por la presencia, paciencia, y constancia. Sus consejos fueron siempre útiles. Gracias por orientarme en este último trayecto que para mí significa tanto. Usted formo una parte importante de esta historia con sus aportes profesionales que lo caracterizan, además de ser una excelente persona es un excelente profesional por lo cual, estoy muy orgullosa de que haya sido usted la persona en guiarme en este último tramo.
Gracias a la Universidad, Bedeles (Patricio y Jorge) y Docentes que me tocaron a lo largo de esta hermosa carrera. Gracias por todo lo enseñado, por ser capaces de formarnos y compartir sus conocimientos de forma profesional con respeto y dedicación.
Donde quiera que vaya, llevare conmigo todas las mejores experiencias.
Gracias a mis amigos y compañeros por acompañarme y estar presentes siempre.
Hicieron que el camino en todos estos años sea más fácil y llevadero. Doy Gracias a Dios y al Universo por habérmelos presentado en mi andar.
Hoy termina esta maravillosa aventura y no puedo dejar de recordar cuantas tardes y horas de estudio pasamos juntos a lo largo de nuestra formación. Llantos, risas, nervios, alegrías, noches sin dormir. Hoy nos toca cerrar un capítulo maravilloso y no puedo dejar de agradecerles por su apoyo. ( Thalita Ríos, Mariana Casagrande, Fernando Baldan, Nicolas Sposari, Florencia Baldini, Belén Torlasco, Antonella Salto). Simplemente Gracias por estar. Me llevo grandes amigos, hermanos del alma.
El gran agradecimiento, sin dudas es para mi familia. Mi mamá, Cristina Legnani, mi papá , Alejandro Campos y a mis hermanos, Jerónimo, Andrea y Francisco Campos.
Los últimos años, si bien fueron difíciles en lo personal, Mi papa comenzó con quimioterapia, mi hermano menor, (quien tiene Síndrome de Angelman) casi parte dos veces. Rendir mis últimos finales estando en terapia intensiva, sostenidos de la mano. Concentrarme no fue fácil, si bien tuve que postergar algunos finales jamás me di por vencida y mi familia estuvo presente alentantandome en cada paso siempre.
Así que, se lo dedico especialmente a Francisco Campos, mi hermano menor. Este logro es tanto suyo como mío y ojalá la vida nos regale muchos momentos más.
Gracias en especial a mi mamá y a mi papá, por ser el gran motor en mi vida, Gracias por impulsar mis sueños y esperanzas por darme palabras de aliento y contención cuando más las necesite. Gracias por estar siempre para mí, en los días y noches más difíciles. Gracias por bancarme mis ausencias, mis horas de estudio, por haberme dado la posibilidad de formarme en esta Universidad. Fueron, son y serán mis mejores guías de vida.
Hoy que concluyo mis estudios, les dedico a ustedes este logro, como una meta más conquistada. Orgullosa de que sean mis papas y que estén a mi lado en este momento tan importante. Gracias por ser quienes son y por creer en mi incluso cuando yo no lo hacía.
Gracias a Dios y a la vida por permitirme llegar a esta instancia. Me costó mucho llegar donde estoy hoy. Y si pudiera viajar tiempo atrás, me abrazaría y me diría: Animo, cree en vos. Si se puede. El esfuerzo y la perseverancia son la clave para lograr todo lo que uno sueña.
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo del presente artículo.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: María Lucía Campos, Marcelo Adrian Estrin.
Investigación: María Lucía Campos, Marcelo Adrian Estrin.
Curación de datos: María Lucía Campos, Marcelo Adrian Estrin.
Análisis formal: María Lucía Campos, Marcelo Adrian Estrin.
Metodología: María Lucía Campos, Marcelo Adrian Estrin.
Redacción – borrador original: María Lucía Campos, Marcelo Adrian Estrin.
Redacción – revisión y edición: María Lucía Campos, Marcelo Adrian Estrin.